题目内容
13.下列反应的离子方程式错误的是( )| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
分析 A.发生氧化还原反应,遵循电子、电荷守恒;
B.反应生成碳酸钡、一水合氨、水;
C.漏写硝酸根离子与碘离子的氧化还原反应;
D.反应生成NaOH、氢气、氯气.
解答 解:A.NaNO2溶液中加入酸性KMnO4溶液的离子反应为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,故A正确;
B.碳酸氢铵溶液中加入足量氢氧化钡溶液的离子反应为NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O,故B正确;
C.Fe(NO3)3溶液中加入过量的HI溶液的离子反应为3NO3-+Fe3++12H++10I-=3NO↑+Fe2++5I2+6H2O,故C错误;
D.用惰性电极电解氯化钠溶液的离子反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断及离子反应中保留化学式的物质、电子和电荷守恒,题目难度不大.

练习册系列答案
相关题目
3.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图1所示:

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
(1)加入NaOH溶液主要为了除去Mg2+(填离子符号),发生反应的离子方程式为MgCO3+2OH-=Mg(OH )2↓+CO32-;“沉淀”的主要成份有Mg(OH)2、Fe(OH)3、CaCO3(填化学式); 向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
4.下列各表述与示意图一致的是( )

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
1.下列说法正确的是( )
| A. | 煤的气化和液化是高效、清洁地利用煤炭的重要途径 | |
| B. | 蚕丝的主要成分是纤维素 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水污染 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ | |
| B. | 强碱性溶液中:NH4+、NO3-、Ba2+、K+ | |
| C. | 澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ | |
| D. | 含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |
18.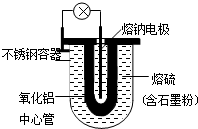 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的负极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |
5.下列说法正确的是( )
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色 |