题目内容
13.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
分析 A.Fe与氯气反应与量无关;
B.n(Cl2):n(FeBr2)=1:1,亚铁离子全部被氧化,溴离子一半被氧化;
C.n(MnO4-):n(H2O2)=2:3时,不遵循电子守恒;
D.n(Fe):n[HNO3(稀)]=1:3,由电子守恒可知,生成亚铁离子和铁离子.
解答 解:A.Fe与氯气反应与量无关,对应反应为3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故A错误;
B.n(Cl2):n(FeBr2)=1:1,亚铁离子全部被氧化,溴离子一半被氧化,对应离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B错误;
C.n(MnO4-):n(H2O2)=2:3时,不遵循电子守恒,则n(MnO4-):n(H2O2)=2:5时对应离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故C错误;
D.n(Fe):n[HNO3(稀)]=1:3,由电子守恒可知,生成亚铁离子和铁离子,离子反应为4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项A为易错点,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
3.在下列反应中水既不是氧化剂又不是还原剂的是( )
| A. | 3Fe+4H2O(g)═Fe3O4+4H2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2? | D. | Cl2+2H2O═HClO+HCl |
8.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol羟基中电子数为9NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
18. A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
2.在中和热的测定实验中,下列溶液组合最合适的是( )
| A. | 50mL 0.50mol/L H2SO4溶液与50mL 0.50mol/L Ba(OH)2溶液 | |
| B. | 50mL 0.50mol/L盐酸溶液与50mL 0.50mol/L NaOH溶液 | |
| C. | 50mL 0.50mol/LCH3COOH溶液与50mL 0.50mol/L NaOH溶液 | |
| D. | 50mL 0.50mol/L盐酸溶液与50mL 0.50mol/L氨水 |
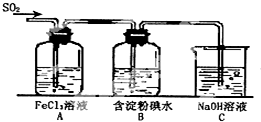 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
