题目内容
8.NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol羟基中电子数为9NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
分析 A、求出丙烷的物质的量,然后根据1mol丙烷中含2mol碳碳单键来分析;
B、羟基不显电性;
C、乙烯和丁烯的最简式均为CH2;
D、标况下甲醇为液态.
解答 解:A、44g丙烷的物质的量为1mol,而1mol丙烷中含2mol碳碳单键,即2NA个,故A错误;
B、羟基不显电性,故1mol羟基含9mol电子即9NA个,故B正确;
C、乙烯和丁烯的最简式均为CH2,故21g混合物中含有的CH2的物质的量为n=$\frac{21g}{14g/mol}$=1.5mol,含有的碳原子为1.5mol,即1.5NA个,故正确;
D、标况下甲醇为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.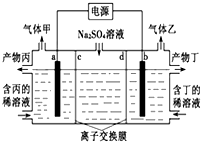 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A. | a极与电源的负极相连 | B. | a电极反应式:2H2O+2e-=H2↑+2OH- | ||
| C. | 离子交换膜d为阴离子交换膜 | D. | 产物丙为硫酸溶液 |
19.下列各组物质属于同分异构体的是( )
| A. | 金刚石和石墨 | B. | 氨基乙酸和硝基乙烷 | ||
| C. |  和 和 | D. | 甲基丙烯酸和甲酸丙酯 |
16.如果发生了氯气泄漏,以下自救方法得当的是( )
| A. | 只要在室内放一盆水 | |
| B. | 向地势低的地方撤离 | |
| C. | 观察风向,顺风撤离 | |
| D. | 用湿毛巾或蘸有弱碱性溶液的毛巾捂住口鼻撤离 |
13.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
20.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+、MnO4-、Na+、Cl- | B. | Fe3+、Na+、Cl-、SO42- | ||
| C. | NH4+、Na+、NO3-、CO32- | D. | Na+、K+、SiO32-、NO3- |
17.下列叙述正确的是( )
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 铁板上镀锡属于电化学防护 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁强 | |
| D. | 将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀 |
18.某无色溶液加人氯化钡溶液后有白色沉淀.再加稀硝酸沉淀不消失,则该溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 至少含有SO42-或SO32-或Ag+ | D. | 一定含有Ag+、SO42- |