题目内容
4.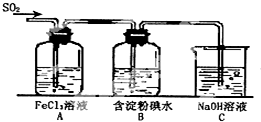 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:(1)SO2气体与Fe3+反应的主要产物是Fe2+、SO42-.(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是B.
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是吸收未反应的SO2,防止空气污染.
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的浓度至少为0.25mol/L才能达到目的.
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是过量的SO2也能使KMnO4溶液褪色.
(6)能表明I-的还原性弱于SO2的现象是装置B中溶液蓝色褪去,写出有关离子方程式:I2+SO2+2H2O=4H++2I-+SO42-.
分析 (1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;
(2)A.硝酸与亚硫酸钠反应生成硫酸钠、NO或NO2;
B.较强酸制较弱酸,浓硫酸不能氧化二氧化硫;
C.生成的二氧化硫混有氧气;
D.生产的二氧化硫混有二氧化碳等杂质;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(4)保证二氧化硫吸收充分,二氧化硫和氢氧化钠的反应为:SO2+NaOH=NaHSO3,据此计算解答;
(5)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析.
解答 解:(1)二氧化硫与铁离子反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,反应中铁离子被氧化成亚铁离子,所以还原产物为亚铁离子;氧化产物是SO42-,
故答案为:Fe2+;SO42-;
(1)A.硝酸具有强氧化性,硝酸与亚硫酸钠反应生成硫酸钠、NO或NO2,故A错误;
B.较强酸制较弱酸,浓硫酸不能氧化二氧化硫,因此可以用Na2SO3固体与浓硫酸制取二氧化硫,故B正确;
C.固体硫在纯氧中燃烧生成二氧化硫,但生成的二氧化硫混有氧气,故C错误;
D.碳与热浓H2SO4反应生成二氧化硫、二氧化碳和水,生产的二氧化硫混有二氧化碳等杂质,故D错误;
故答案为:B;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染,
故答案为:吸收未反应的SO2,防止空气污染;
(4)如果有280mL即0.0125molSO2气体(已折算为标态)进入C装置中,则C中,SO2+NaOH=NaHSO3,至少需要氢氧化钠的物质的量是0.0125mol,浓度是$\frac{0.0125mol}{0.05L}$=0.25mol/L,故答案为:0.25;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,
Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;过量的SO2也能使KMnO4溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,I2+SO2+2H2O=2HI+H2SO4其反应的离子方程式为:I2+SO2+2H2O=4H++2I-+SO42-,
故本题答案为:装置B中溶液蓝色褪去;I2+SO2+2H2O=4H++2I-+SO42-.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化还原反应的计算、氧化性还原性强弱比较、性质实验方案的设计与评价等知识,侧重学生分析能力和计算能力的考查,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键.

| A. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ |
| A. | 金刚石和石墨 | B. | 氨基乙酸和硝基乙烷 | ||
| C. |  和 和 | D. | 甲基丙烯酸和甲酸丙酯 |
| A. | 体积不变充入N2使压强增大 | B. | 体积不变充入O2使压强增大 | ||
| C. | 使体积增大到原来的2倍 | D. | 体积不变充入氦气使压强增大 |
| A. | 只要在室内放一盆水 | |
| B. | 向地势低的地方撤离 | |
| C. | 观察风向,顺风撤离 | |
| D. | 用湿毛巾或蘸有弱碱性溶液的毛巾捂住口鼻撤离 |
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
| A. | 空气 | B. | 漂白粉 | C. | 氧化铝 | D. | 镁铝合金 |
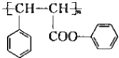 )是一种环保型的新涂料,其合成路线如下图所示:
)是一种环保型的新涂料,其合成路线如下图所示: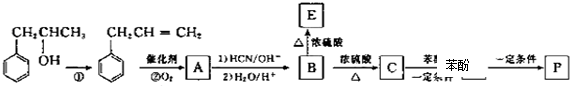
 ,E是高分子化台物,其结构简式为
,E是高分子化台物,其结构简式为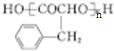 ;
;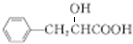 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$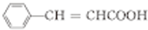 +H2O;
+H2O;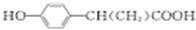 (写出其中一种的结构简式).
(写出其中一种的结构简式).