题目内容
3.在下列反应中水既不是氧化剂又不是还原剂的是( )| A. | 3Fe+4H2O(g)═Fe3O4+4H2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2? | D. | Cl2+2H2O═HClO+HCl |
分析 水既不是氧化剂又不是还原剂,则水中H、O元素的化合价均不变,以此来解答.
解答 解:A.水中H元素的化合价降低,水为氧化剂,故A不选;
B.水中H元素的化合价降低,水为氧化剂,故B不选;
C.水中O元素的化合价升高,水为还原剂,故C不选;
D.只有Cl元素的化合价变化,则水既不是氧化剂又不是还原剂,故D选;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂判断的考查,题目难度不大.

练习册系列答案
相关题目
13.蒸发操作中必须用到蒸发皿,下列有关蒸发皿的操作中,不正确的是( )
| A. | 将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热 | |
| B. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| C. | 将蒸发皿放置在三脚架上直接用酒精灯火焰加热 | |
| D. | 将灼热的蒸发皿放置一段时间变凉后,放在冷水中冲洗 |
18.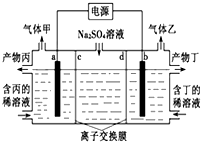 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A. | a极与电源的负极相连 | B. | a电极反应式:2H2O+2e-=H2↑+2OH- | ||
| C. | 离子交换膜d为阴离子交换膜 | D. | 产物丙为硫酸溶液 |
8.1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要20-50Mpa的高压和500℃的高温下,用铁作催化剂,且氨的产率为10%-15%.2005年美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2C12的铁化合物作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2=2NH3,下列有关说法正确的是( )
| A. | 不同的催化剂对化学反应速率的影响均相同 | |
| B. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| C. | 新法合成能在常温下进行是因为不需要锻炼化学键 | |
| D. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展愿景 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ |
13.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.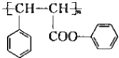 )是一种环保型的新涂料,其合成路线如下图所示:
)是一种环保型的新涂料,其合成路线如下图所示: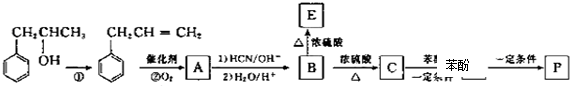
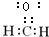 ,E是高分子化台物,其结构简式为
,E是高分子化台物,其结构简式为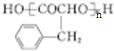 ;
;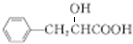 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$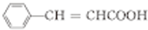 +H2O;
+H2O;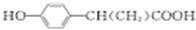 (写出其中一种的结构简式).
(写出其中一种的结构简式).