题目内容
某强酸性溶液X可能含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是______,不能确定是否含有的离子(M)是______,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是______.
(2)写出反应②的离子方程式:______.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式______.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有______.
(1)NH4+、Fe2+、SO42- ;Fe3+、Cl- 取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl-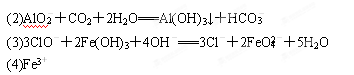
解析试题分析:据题意可知X为强酸性溶液所以CO32-、SO32不能存在X溶液中,加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42-存在;加入硝酸钡,还可以产生气体,原因只能是硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O).再由溶液B加入过量NaOH溶液,能产生沉淀,则说明该生成的沉淀G为
Fe(OH)3;生成的气体F为NH3,说明有NH4+存在.再由溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;上述实验过程还不能确定溶液X中是否存在C1-.
考点:考查常见离子的检验,如氨气的检验、铝离子的检验

下列离子方程式正确的是
| A.铝溶于NaOH溶液:Al+2OH-=AlO2-+H2↑ |
| B.铜溶于稀硝酸:3Cu+ 8H+ +2NO3-=3Cu2+ +2NO↑ + 4H2O |
| C.碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑ + H2O |
| D.稀硫酸中滴加氢氧化钡溶液:H++OH-=H2O |
下列反应的离子方程式中,书写正确的是
| A.氯气溶于水:H2O + C12=2H+ + ClO- + Cl- |
| B.将铝粉投入氢氧化钠溶液中:2Al + 2OH-=2AlO2- + H2↑ |
| C.铁粉与氯化铁溶液反应:Fe + Fe3+=2Fe2+ |
| D.过氧化钠与水反应:2Na 2O2+ 2H2O=4Na+ + 4OH-+ O2↑ |
下列化学反应的离子方程式不正确的是
| A.Na2S溶液中加入少量FeCl3溶液:2Fe3++S2- = 2Fe2++S↓ |
| B.向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32- |
| C.向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O = SO42-+Cl-+2H+ |
D.Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: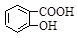 +CO32- +CO32- 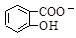 +HCO3- +HCO3- |
某无色溶液中含有:①Na+ ②Ba2+ ③Cl- ④Br- ⑤SO⑥SO中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下表,下列结论正确的是
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)中的溶液过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
C.可能含有的离子是①②⑥ D.不能确定的离子是①③⑥
(12分)卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。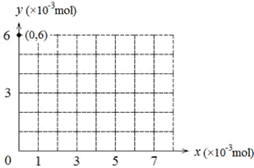
查阅资料如下:
①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3-+ I2 = 2IO3-+ Br2
③ IO3-+ 5I-+ 6H+ = 3I2 + 3H2O ④ 2IO3-+ 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步 骤 | 现 象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
(15分)实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用)。
可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、 碱石灰、Cu、Zn、Na2S |
(1)装置B中a仪器的名称 。
(2)可由A装置制取相对分子质量小于32的气体有 (任意写2种)。
(3)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→ →C← ← ←B。写出装置B(无需加热)中反应的离子方程式 。
(4)完成上述实验需选用仪器D和E,D中选用( )、E中选用( )(填写序号)
A.无水氯化钙 B.饱和碳酸氢钠溶液 C.饱和食盐水
D.五氧化二磷 E.碱石灰 F.浓硫酸
(5)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式 。
(6)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
| A.Cl2 | B.H2O2 | C.ClO2 | D.O3 |
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。