题目内容
下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题.
(1)这11种元素中,化学性质最不活泼的元素是
(2)元素④的离子结构示意图为 ;
;
(3)⑥、⑦、⑧气态氢化物的化学式分别为
(4)③和⑨两种元素形成的化合物属于 .
. ..
..
(5)写出③的单质置换出⑥的单质的化学方程式
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
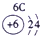
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
Ne
Ne
(用元素符号或化学式表示,下同),得电子能力最强的原子对应的单质是F2
F2
,失电子能力最强的原子对应的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
.常温下为液态的非金属单质是Br2
Br2
.(2)元素④的离子结构示意图为
 ;
;(3)⑥、⑦、⑧气态氢化物的化学式分别为
CH4
CH4
、PH3
PH3
、HF
HF
,其中以HF
HF
最稳定.⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:H3PO4
H3PO4
、HClO4
HClO4
;其中以HClO4
HClO4
酸性最强.(4)③和⑨两种元素形成的化合物属于
离子化合物
离子化合物
(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 .
. .
.(5)写出③的单质置换出⑥的单质的化学方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
分析:根据元素在元素周期表中的位置可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为P,⑧为F,⑨为Cl,⑩为Ne,
(1)原子结构中最外层电子数为8时为稳定结构,非金属性越强,得电子能力越强,金属性越强,与水反应越剧烈,溴单质在常温下为液体;
(2)利用质子数及电子排布规律来分析;
(3)非金属性越强,气态氢化物越稳定,元素最高价氧化物对应水化物的酸性越强;
(4)金属元素与非金属元素易形成离子化合物;
(5)镁与二氧化碳能发生置换反应.
(1)原子结构中最外层电子数为8时为稳定结构,非金属性越强,得电子能力越强,金属性越强,与水反应越剧烈,溴单质在常温下为液体;
(2)利用质子数及电子排布规律来分析;
(3)非金属性越强,气态氢化物越稳定,元素最高价氧化物对应水化物的酸性越强;
(4)金属元素与非金属元素易形成离子化合物;
(5)镁与二氧化碳能发生置换反应.
解答:解:根据元素在元素周期表中的位置可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为P,⑧为F,⑨为Cl,⑩为Ne,
(1)上述元素中只有Ne最外层电子数为8,为稳定结构,则化学性质最不活泼的元素Ne,上述元素中只有F的非金属性最强,则F2得电子能力最强,只有K的金属性最强,与水反应剧烈,该反应为2K+2H2O=2KOH+H2↑,溴单质在常温下为液体,其化学式为Br2,故答案为:Ne;F2;2K+2H2O=2KOH+H2↑;Br2;
(2)Ca的质子数为20,易失去最外层2个电子变为钙离子,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)⑥为C,⑦为P,⑧为F,氢化物分别为CH4、PH3、HF,F非金属性最强,则HF越稳定;非金属性Cl>P,则元素最高价氧化物对应水化物分别为HClO4、H3PO4,HClO4的酸性强,
故答案为:CH4;PH3;HF;HF;H3PO4;HClO4;HClO4;
(4)Mg与Cl形成离子化合物为氯化镁,用电子式表示其形成过程为 ,
,
故答案为:离子化合物; ;
;
(5)镁与二氧化碳发生的置换反应为2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C.
(1)上述元素中只有Ne最外层电子数为8,为稳定结构,则化学性质最不活泼的元素Ne,上述元素中只有F的非金属性最强,则F2得电子能力最强,只有K的金属性最强,与水反应剧烈,该反应为2K+2H2O=2KOH+H2↑,溴单质在常温下为液体,其化学式为Br2,故答案为:Ne;F2;2K+2H2O=2KOH+H2↑;Br2;
(2)Ca的质子数为20,易失去最外层2个电子变为钙离子,离子结构示意图为
 ,故答案为:
,故答案为: ;
;(3)⑥为C,⑦为P,⑧为F,氢化物分别为CH4、PH3、HF,F非金属性最强,则HF越稳定;非金属性Cl>P,则元素最高价氧化物对应水化物分别为HClO4、H3PO4,HClO4的酸性强,
故答案为:CH4;PH3;HF;HF;H3PO4;HClO4;HClO4;
(4)Mg与Cl形成离子化合物为氯化镁,用电子式表示其形成过程为
 ,
,故答案为:离子化合物;
 ;
;(5)镁与二氧化碳发生的置换反应为2Mg+CO2
| ||
| ||
点评:本题考查位置、结构、性质的应用,学生应熟悉元素在周期表的位置来解答,并熟悉比较元素金属性、非金属性的方法,注重归纳来分析解答即可.

练习册系列答案
相关题目









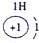
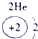
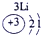
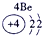
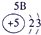
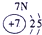
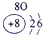
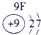
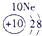
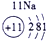





 表示的是
表示的是