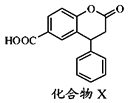
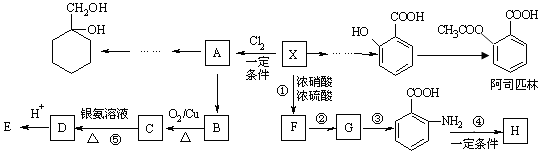
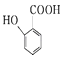
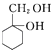
题目内容
【题目】下列解释事实的方程式不正确的是( )
A. 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2=2Na2O
B. 硫酸铵溶液与氢氧化钡溶液混合后加热,产生气体:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-=2AlO2-+H2O
D. 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-=Ag2S+2I-
【答案】B
【解析】A、钠具有强还原性,在空气中易被氧化为Na2O,颜色变暗,方程式正确,故A正确;B、硫酸铵与氢氧化钡反应,除了NH4+与OH-的反应之外,还有Ba2+和SO42-的反应,离子方程式错误,故B错误;C、铝表面易形成氧化铝薄膜,插入NaOH溶液中,NaOH先要溶解表面的氧化铝,再与Al单质反应产生气泡,方程式正确,故C正确;D、碘化银悬浊液中存在溶解平衡AgI(s) Ag+ + I-,加入硫化钠,S2-与Ag+结合为更难溶的Ag2S,即碘化银转化为硫化银,方程式正确,故D正确。故选B。

【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答下列问题。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)第三周期中元素非金属性最强的元素的原子结构示意图是_____________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是_________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是________________(填序号)。
a. 单质的熔点⑤比⑥低 b. 化合价⑤比⑥低
c. 单质与水反应⑤比⑥剧烈 d. 最高价氧化物的水化物的碱性⑤比⑥强
(5)为验证ⅦA族部分元素非金属性的递变规律,设计下图装置进行实验,请回答:
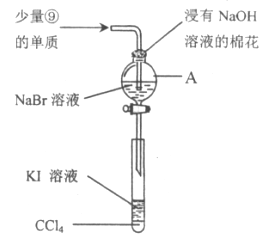
①仪器A的名称是_____________,A中发生的反应的离子方程式是_________。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)_____________________。
③为验证溴与碘非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____________________。该实验必须控制加入的⑨单质的量,否则得不出溴的非金属性比碘强。理由是_____________________。
④ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______________(填“增大”或“减小”),得电子能力逐渐减弱。