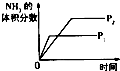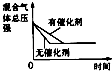题目内容
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答下列问题。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)第三周期中元素非金属性最强的元素的原子结构示意图是_____________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是_________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是________________(填序号)。
a. 单质的熔点⑤比⑥低 b. 化合价⑤比⑥低
c. 单质与水反应⑤比⑥剧烈 d. 最高价氧化物的水化物的碱性⑤比⑥强
(5)为验证ⅦA族部分元素非金属性的递变规律,设计下图装置进行实验,请回答:
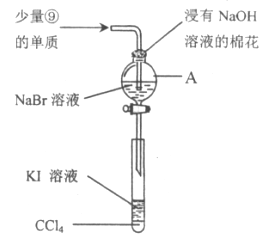
①仪器A的名称是_____________,A中发生的反应的离子方程式是_________。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)_____________________。
③为验证溴与碘非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____________________。该实验必须控制加入的⑨单质的量,否则得不出溴的非金属性比碘强。理由是_____________________。
④ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______________(填“增大”或“减小”),得电子能力逐渐减弱。
【答案】 ![]() HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3 ![]() cd 分液漏斗 2Br-+Cl2=Br2+2C1- Cl2+2OH-=H2O+Cl-+ClO- 溶液分层,下层液体为紫红色 氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果 增大
cd 分液漏斗 2Br-+Cl2=Br2+2C1- Cl2+2OH-=H2O+Cl-+ClO- 溶液分层,下层液体为紫红色 氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果 增大
【解析】(1)同一周期元素,从左到右元素的非金属性随原子序数增大而增大;(2)元素非金属性越强,其最高价氧化物的水化物酸性越强;(3)依据氯化氢是共价化合物书写电子式;
(4)根据单质与水反应剧烈程度或最高价氧化物的水化物的碱性强弱来判断;(5)①由图可以知道,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应;②NaOH溶液吸收多余氯气;③碘在四氯化碳中为紫红色;氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果;④同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱。
详解:(1) 第三周期中元素非金属性最强的元素是Cl,原子结构示意图是![]() ;
;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强;②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3。
(3)HCl是共价化合物,形成过程表示为:![]() 。
。
(4)比较钠和铝的金属性强弱:a. 单质的熔点不能比较,a错误;b. 化合价高低不能比较,b错误;c. 单质与水反应Na比Al剧烈,可以比较,c正确;d. 最高价氧化物的水化物的碱性NaOH比Al(OH)3强,可以比较,d正确;故选cd。
(5)①由图可以知道,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应,该离子反应为:2Br-+Cl2=Br2+2C1-;
因此,本题正确答案是:分液漏斗;2Br-+Cl2=Br2+2C1-;
②NaOH溶液吸收氯气,离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-;
③溴与KI反应生成碘,碘易溶于四氯化碳,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色,因此,本题正确答案是:溶液分层,上层几乎无色,下层呈紫红色;若通入过量氯气,剩余的氯气能够进入试管氧化碘离子,干扰了溴与碘离子的反应,所以氯水滴加少量的原因是:氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果;
因此,本题正确答案是:氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果。
④同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱;
因此,本题正确答案是:增大。

【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
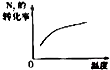
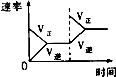
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D