题目内容
【题目】硫酸是化工行业广泛应用的基础原料,某化学兴趣小组为探究浓硫酸所具有的一些特殊性质,进行如下有关实验。
实验一:浓硫酸与铜反应
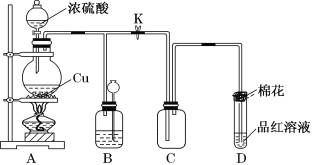
(1)装置A中发生反应的化学方程式为_____________________________;当反应转移0.2mol电子时,生成气体在标况下的体积为_________L。
(2)装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是______________;
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是________________,B中应放置的溶液是________。
A 水 B 酸性KMnO4溶液 C 浓溴水 D 饱和NaHSO3溶液
实验二:浓硫酸与碳反应,并验证反应生成的气体产物
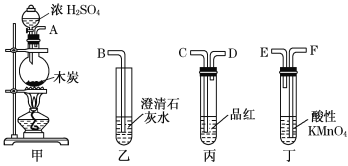
(4)冯同学认为按照甲、丙、丁、乙的装置顺序,即可验证产物为SO2和CO2,那么丁中酸性KMnO4溶液的作用是______________;
(5)陈同学认为丙装置要使用两次才能确保检验气体产物的准确性,如按该同学所说,气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A——________________________________________——B;能说明气体产物中有CO2的实验现象是①__________________②____________________。
【答案】2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O 2.24 吸收多余的SO2 溶液倒流回长颈漏斗中 D 除去CO2中的SO2 CDFECD 第二个丙装置不褪色 乙中生成白色沉淀
CuSO4+SO2↑+2H2O 2.24 吸收多余的SO2 溶液倒流回长颈漏斗中 D 除去CO2中的SO2 CDFECD 第二个丙装置不褪色 乙中生成白色沉淀
【解析】
(1)浓硫酸和铜反应生成硫酸铜、二氧化硫和水,结合元素的化合价变化情况分析解答;
(2)根据二氧化硫有毒,属于大气污染物分析判断;
(3)装置B的作用是贮存多余的气体,结合二氧化硫的性质分析判断;
(4)根据二氧化硫能干扰二氧化碳的检验分析判断;
(5)检验二氧化硫用品红溶液,检验二氧化碳用澄清石灰水,但二氧化硫能干扰二氧化碳的检验,结合装置图分析解答。
(1)装置A中浓硫酸和铜在加热的条件下反应生成硫酸铜、二氧化硫和水,发生反应的化学方程式为2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O;反应中硫元素化合价从+6价降低到+4价得到2个电子,则当反应转移0.2mol电子时,生成气体在标况下的体积为0.1mol×22.4L/mol=2.24L;
CuSO4+SO2↑+2H2O;反应中硫元素化合价从+6价降低到+4价得到2个电子,则当反应转移0.2mol电子时,生成气体在标况下的体积为0.1mol×22.4L/mol=2.24L;
(2)二氧化硫有毒,需要尾气处理,又因为二氧化硫是酸性氧化物,则装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是吸收多余的SO2,防止污染空气;
(3)装置B的作用是贮存多余的气体,则B中应放置的溶液不能溶解或吸收二氧化硫,酸性高锰酸钾溶液和溴水均能氧化二氧化硫,二氧化硫易溶于水,所以B中溶液应该是饱和的亚硫酸氢钠溶液,答案选D;当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是溶液倒流回长颈漏斗中。
(4)由于二氧化硫和二氧化碳均是酸性氧化物,都能使澄清石灰水先变浑浊后澄清,则检验二氧化碳之前要首先除去二氧化硫,即丁中酸性KMnO4溶液的作用是除去CO2中的SO2;
(5)由于二氧化硫能干扰二氧化碳,则检验二氧化碳之前要首先除去二氧化硫,且还需要检验二氧化硫是否除尽,则按气流由左向右流向,连接上述装置的正确顺序是ACDFECDB;能说明气体产物中有CO2的实验现象是第二个丙装置不褪色,乙中生成白色沉淀。