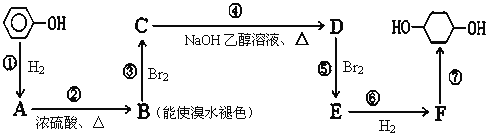
题目内容
【题目】现有易溶强电解质的混合溶液10 L,其中可能含K+、Ba2+、Na+、![]() 、Cl、
、Cl、![]() 、
、![]() 、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
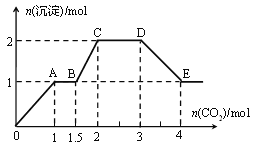
下列说法正确的是
A.该溶液中能确定存在的离子是Ba2+、![]() 、
、![]()
B.肯定不存在的离子是![]() 、OH
、OH
C.若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2 mol·L1
D.OA 段反应的离子方程式:2![]() +CO2+3H2O===2Al(OH)3↓+
+CO2+3H2O===2Al(OH)3↓+![]()
【答案】C
【解析】
试题分析:通入CO2气体,两次产生沉淀只可能是BaCO3和Al(OH)3,因此溶液中必含有Ba2+和![]() ,考虑到
,考虑到![]() 存在于碱性环境中,则溶液中含有OH,Ba2+与
存在于碱性环境中,则溶液中含有OH,Ba2+与![]() 反应生成BaSO4沉淀而不能共存,
反应生成BaSO4沉淀而不能共存,![]() 与OH反应放氨气而不能共存,故溶液中一定含有Ba2+、
与OH反应放氨气而不能共存,故溶液中一定含有Ba2+、![]() 、OH,肯定不存在
、OH,肯定不存在![]() 、
、![]() ,不能确定的离子有K+、Na+、Cl,即A、B不正确;图像中的OA段,通入1 mol CO2生成1 mol沉淀,因此OA段的离子方程式为Ba2++2OH+CO2===BaCO3↓+H2O,故D不正确;根据以上分析,图中各段发生反应的离子方程式分别为:OA段为①Ba2++2OH+CO2===BaCO3↓+H2O、AB段为②2OH+CO2===
,不能确定的离子有K+、Na+、Cl,即A、B不正确;图像中的OA段,通入1 mol CO2生成1 mol沉淀,因此OA段的离子方程式为Ba2++2OH+CO2===BaCO3↓+H2O,故D不正确;根据以上分析,图中各段发生反应的离子方程式分别为:OA段为①Ba2++2OH+CO2===BaCO3↓+H2O、AB段为②2OH+CO2=== ![]() +H2O、BC段为③2
+H2O、BC段为③2 ![]() +CO2+3H2O=== 2Al(OH)3↓+
+CO2+3H2O=== 2Al(OH)3↓+![]() 、CD段为④
、CD段为④![]() +CO2+H2O===
+CO2+H2O=== ![]() 、DE段为⑤BaCO3+CO2+H2O===Ba2++2
、DE段为⑤BaCO3+CO2+H2O===Ba2++2![]() ,从图像知n(Ba2+)=1 mol、n(
,从图像知n(Ba2+)=1 mol、n(![]() )=1mol,由反应①、②得n(OH)=3n(CO2)= 3mol,溶液阴离子所带电荷数大于阳离子所带电荷数,因此在不能确定离子中至少还存在一种阳离子,即K+、Na+中至少存在一种,当溶液中不存在Cl时,该阳离子的浓度为
)=1mol,由反应①、②得n(OH)=3n(CO2)= 3mol,溶液阴离子所带电荷数大于阳离子所带电荷数,因此在不能确定离子中至少还存在一种阳离子,即K+、Na+中至少存在一种,当溶液中不存在Cl时,该阳离子的浓度为![]() ,当溶液中存在Cl时,溶液中阴离子所带电荷数增加,则所求离子的浓度大于0.2 mol·L1,故C正确。特别提醒:反应②不能为OH+CO2===
,当溶液中存在Cl时,溶液中阴离子所带电荷数增加,则所求离子的浓度大于0.2 mol·L1,故C正确。特别提醒:反应②不能为OH+CO2===![]() ,因为
,因为![]() 可以与
可以与![]() 反应:
反应:![]() +
+![]() +H2O===Al(OH)3↓+
+H2O===Al(OH)3↓+ ![]() 。
。

【题目】某同学想通过下图装置实验,探究 SO2 与 Na2O2反应的产物。
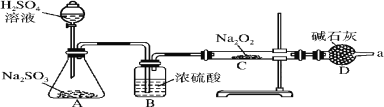
Ⅰ、检验反应中是否有 O2 生成的方法是_______________________________________;若有 O2 生成,请写出装置 C 中的化学方程式:________________________。
Ⅱ、A 中盛装 H2SO4 溶液的仪器名称是________;D 装置除起了防止空气中的水蒸气和二氧化碳进入 C 装置与 Na2O2 反应作用外,还可以________________________________。
Ⅲ、(1)C 中固体产物可能有三种情况:①只有 Na2SO3;②只有________;③Na2SO3 和 Na2SO4 混合物。
(2)若 Na2O2 反应完全,为确定 C 中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程。限选试剂和仪器:
0.01 mol·L-1 KMnO4酸性溶液 0.1 mol·L-1 Ba(NO3)2 溶液 0.1 mol·L BaCl2
1 mol·L-1 HNO3 溶液 1 mol·L-1 盐酸、试管、胶头滴管。
实验操作 | 预期现象和结论 |
步骤一:取少量 C 中固体产物 于试管中,加入适量的蒸馏水、 搅拌溶解,分别取少量于 A、B 试管中 | 固体完全溶解,得到无色透明溶液 |
步骤二:取试管 A,向溶液中 加入________________,振荡,观察溶液颜色变化 | __________________________ |
步骤三:取试管 B,向其中先 加入__________________ ,振 荡;再加入_______________,振荡 | 产生气泡 ,再加入 另一试剂看到产生白色沉淀, 则固体 C 中还含有________ |