题目内容
【题目】工业制硫酸的关键反应是二氧化硫催化氧化为三氧化硫,其反应方程式2SO2g)+O2(g)![]() 2SO3(g)。回答下列有关问题:
2SO3(g)。回答下列有关问题:
(1)如果此反应用氧气表示的化学反应速率是v(O2)=0.05mol/(L·s),则用二氧化硫表示的v(SO2)=______________.
(2)其它条件不变,若升高温度,此反应会向逆反应方向移动,则正反应速率______________,逆反应速率______________(填增大或减小),正反应是______________反应(填吸热或放热)。
(3)其它条件不变,增大氧气的浓度,会使SO2的转化率______________。
(4)下列条件能够判断此反应已经达到化学平衡状态的是______________
A.单位时间内消耗1molSO2的同时生成1molSO3
B.恒温恒容条件下体系的总压强不在随时间的变化而变化
C.恒温恒容条件下混合气体的密度不再随时间的变化而变化
D.2v(O2)正= v(SO2)逆时
【答案】0.1mol/(L·s) 增大 增大 放热 增大 BD
【解析】
(1)如果此反应用氧气表示的化学反应速率是v(O2)=0.05mol/(L·s),根据同一反应中,各物质的反应速率之比等于方程式中各物质的化学计量数之比,所以用二氧化硫表示的v(SO2)= 0.1mol/(L·s);
(2)升高温度,正反应速率还是逆反应速率都会增大,只不过增大的程度不同,因升高温度此反应会向逆反应方向移动,所以逆反应为吸热反应,则该反应的正反应是放热反应;
(3)其它条件不变,增大氧气的浓度,使得平衡向右移动,SO2的转化率会增大;
(4)A.单位时间内消耗1mol SO2的同时生成1mol SO3,均表示的是正反应速率,无法判断此反应已经达到化学平衡状态,A不符合题意;
B.该反应是一个气体系数减小的反应,根据PV=nRT可知,恒温恒容条件下,体系的总压强不再随时间的变化而变化说明此反应已经达到化学平衡状态,B符合题意;
C.该反应无论是反应物还是生成物均为气体物质,混合气体的总质量不变,恒容条件下混合气体的密度保持恒定,所以混合气体的密度不再随时间的变化而变化无法判断此反应是否已经达到化学平衡状态,C不符合题意;
D.2v(O2)正=v(SO2)逆,说明反应的正逆反应速率相等,说明此反应已经达到化学平衡状态,D符合题意;
答案选BD。

【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
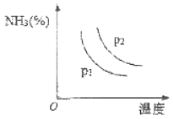
【题目】肼(N2H4)是一种应用广泛的化工原料。工业上先合成氨气:N2(g)+3H2(g) ![]() 2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:
2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:

(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是___(填“A”或“B”或“C”),理由是:________________。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
反应速率 | 平衡常数K | 氨的体积分数 | |
变化情况 | __ | ____ | ____ |
(3)肼可作为火箭燃料,4gN2H4(g)在NO2气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:________。
(4)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。判断pl、p2压强的大小关系,pl___p2(选填“>”、“<”或“=”)。