题目内容
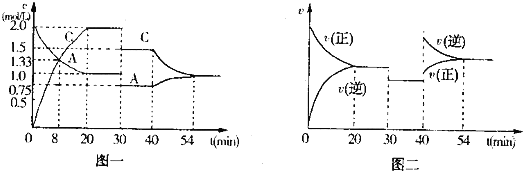
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系分别如图一、图二所示。
请回答下列问题:
(1)020min,A的平均反应速率为___mol/(Lmin);8min时,v(正)___v(逆)。(填“>”“=”或“<”)
(2)30min时改变的反应条件是___.
(3)40min时改变的条件是升高温度,则该反应的正反应为___(填“吸热”或“放热”)反应。
(4)能判断该反应是否达到化学平衡状态的依据是______(多项选择)。
a.容器内压强不变 b.混合气体中c(A)不变
c.v正(A)=v逆(B) d.c(A)=c(C)
【答案】0.05 > 减小压强 放热 bc
【解析】
由题可知,该化学反应为反应前后气体分子数不变的反应,结合图一、图二分析,在20min~30min,A、C浓度不再发生变化,正逆反应速率相等,此时达到化学平衡状态。30min~40min时,A、C浓度均减小,化学平衡没有移动。40min~54min时,A浓度减小,C浓度增大,正逆反应速率都增大,但![]() 。
。
(1)020min,A的浓度的变化量=![]() ,根据化学反应速率的定义,可知A的平均反应速率为:
,根据化学反应速率的定义,可知A的平均反应速率为:![]() ;由图二可知,8min时,反应未达平衡状态,此时反应速率v(正)>v(逆)。故答案为:0.05;>。
;由图二可知,8min时,反应未达平衡状态,此时反应速率v(正)>v(逆)。故答案为:0.05;>。
(2)30min~40min时,A、C浓度均减小,但化学平衡没有移动,则可能是减小了压强,使体系的容积增大,A、C浓度减小,因为反应是反应前后气体分子数不变的反应,改变压强对平衡无影响。故答案为:减小压强。
(3)分析图一,可知40min时升高温度,C浓度减小,A浓度增大,说明反应向逆反应方向进行,故正反应为放热反应。或由图二可知,40min时,正逆反应速率都增大,且![]() ,说明反应逆向进行,可知正反应为放热反应,故答案为:放热。
,说明反应逆向进行,可知正反应为放热反应,故答案为:放热。
(4)a.该反应为气体分子数不变的反应,容器内压强不变不能说明反应达平衡状态,a错误;
b.反应达平衡时,各组分的浓度保持不变,故混合气体中c(A)不变,可以说明反应达平衡状态,b正确;
c.同一反应中,不同物质的反应速率之比等于化学方程式中相应物质的化学计量数之比,故v正(A)= v正(B)。反应达平衡状态时有v正(B)=v逆(B),可知,v正(A)=v逆(B),c正确;
d.c(A)=c(C)并不能说明反应是否达平衡状态,d错误;
答案选bc。

【题目】下列实验、现象及相关结论均正确的是
A | B | C | D | |
实验 |
|
|
|
|
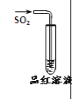
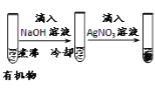
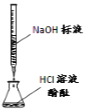
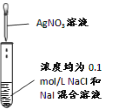
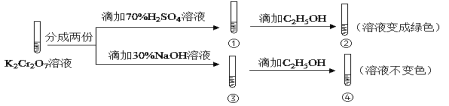
现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30s不复原 | 出现白色沉淀 |
结论 | SO2 有强强氧化性 | 有机物中含有溴原子 | 滴定达终点 | Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D