题目内容
已知某可逆反应:mA(g)+nB(g)  pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是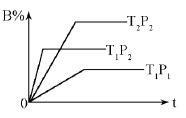
| A.T2>T1P1> P2 m+n > p Δ Η<0 |
| B.T1>T2P1< P2 m+n < p Δ Η>0 |
| C.T1<T2P1< P2 m+n < p Δ Η<0 |
| D.T1 >T2P1< P2 m+n > p Δ Η>0 |
B
解析试题分析:因为T2P2与T1P2相比较,在横坐标上T1P2到达平衡用时少,则说明T1>T2,在纵坐标上T2P2对应的B%的量高,所以温度越小,B%的量越高,则Δ Η>0。又可以用T1P2和T1P1相比较,在横坐标上,T1P2用时少,说明P1< P2,又因为在纵坐标上T1P2对应的B%的量高,说明压强增大,平衡逆移,可以推出m+n < p。可以说明答案为B。
考点:影响平衡的条件和影响反应速率的条件。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列不能用勒夏特列原理解释的是
| A.棕红色NO2加压后颜色先变深后变浅 |
| B.冰镇啤酒打开瓶塞后产生大量泡沫 |
| C.在H2,I2(g)和HI组成的平衡体系中加压后,混合物颜色加深 |
| D.Fe(SCN)3溶液中加入固体KSCN后颜色变化 |
已知298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
| A.Q1=Q2=197KJ | B.Q1<Q2<197KJ | C.Q2<Q1<197KJ | D.Q1=Q2<197KJ |
下列事实不能用勒夏特列原理来解释的是
| A.加压有利于SO2与O2反应生成SO3 |
| B.温度过高对合成氨反应不利 |
| C.高温及加入催化剂都能使合成氨的反应速率加快 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |
在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g) 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
| A.40% | B.50% | C.60% | D.70% |
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
| A.产物B的状态可能为固态或液态 |
| B.平衡时,单位时间内A和B消耗的物质的量之比为1:1 |
| C.保持体积不变,向平衡体系中加入A(s),平衡不移动 |
| D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ |
 2C(g) ΔH<0,这个反应的正确图像为( )
2C(g) ΔH<0,这个反应的正确图像为( )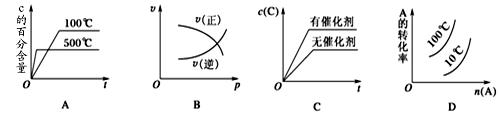
 4NO(g) + 6H2O(g) ΔH=-1025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g) + 6H2O(g) ΔH=-1025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是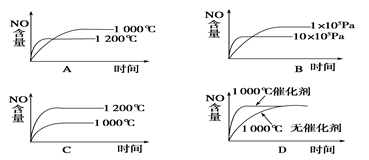
 B(g) + C(g);ΔH = ?48.25 kJ/L
B(g) + C(g);ΔH = ?48.25 kJ/L