题目内容
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
下列叙述不正确的是
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其盐溶液的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
AB
解析试题分析:甲和丙的主要化合价是+1价,属于第IA族元素。乙和丁的主要化合价是-2价,则位于第ⅥA族。同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以甲是Na,乙是S,丙是Li,丁是O。A、Na和Li都是金属晶体,金属晶体的离子半径越小,金属键越强,晶体的熔点越高。钠离子半径大于锂离子半径,因此Li的熔点高于钠的熔点,A不正确;钠是活泼的金属,应该通过电解熔融的氯化钠冶炼,电解氯化钠溶液生成氢氧化钠、氢气和氯气,B不正确;C、氧元素的两种氢化物水和双氧水,在常温下均是液体,C正确;D、硫离子核外电子层数是3层,电子层数最多,因此离子半径最大。核外电子排布相同的微粒,其离子半径随原子序数的增大而减小,因此微粒半径大小顺序是S2->O2->Na+>Li+,D正确,答案选AB。
考点:考查元素周期律的应用

练习册系列答案
相关题目
下列各组物质的性质比较中不正确的是
| A.热稳定性:SiH4>PH3>H2 S |
| B.酸性:HClO4>H2SO4>H3 PO4 |
| C.碱性:NaOH>Mg(OH)2>AI(OH)3 |
| D.氧化性:F2>C12>Br2 |
下列关于第IVA族元素的说法中,正确的是
| A.原子半径:14Si>32Ge |
| B.稳定性:CH4<SiH4 |
| C.酸性:H2CO3>H2SiO3 |
| D.碱性:32Ge(OH)4>50Sn(OH)4>82Pb(OH)4 |
下列说法错误的是
| A.化学可以识别、改变和创造分子 |
| B.在化学反应中,反应前后电子总数可能发生变化 |
| C.摩尔是一个单位,用于计量物质所含微观粒子的多少 |
| D.在化学反应中,反应前后原子种类、原子数目和质量一定不变 |
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是
| A.M元素存在同素异形体 |
| B.M元素为非金属元素 |
| C.M的最高价氧化物对应的水化物都是强酸 |
| D.常温下,能稳定存在的M的氧化物都是酸性氧化物 |
下列物质性质的变化规律中与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高;②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅;④NaF、NaCl、NaBr、NaI熔点依次降低
| A.仅③ | B.①③ | C.②④ | D.②③ |
下表是元素周期表的一部分,有关说法不正确的是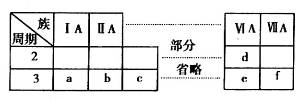
| A.元素e的氧化物对应的水化物均为强酸 |
B.a、b、d、e四种元素的离子半径: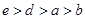 |
| C.b、f两种元素形成的化合物为离子化合物 |
| D.a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
| A.1s22s22p63s23p2→1s22s22p63s23p1 |
| B.1s22s22p63s23p3→1s22s22p63s23p2 |
| C.1s22s22p63s23p4→1s22s22p63s23p3 |
| D.1s22s22p63s23p63d104s24p1 →1s22s22p63s23p63d104s2 |