题目内容
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
| A.1s22s22p63s23p2→1s22s22p63s23p1 |
| B.1s22s22p63s23p3→1s22s22p63s23p2 |
| C.1s22s22p63s23p4→1s22s22p63s23p3 |
| D.1s22s22p63s23p63d104s24p1 →1s22s22p63s23p63d104s2 |
B
解析试题分析:由原子核外电子排布可知A、B、C、D依次为Si、P、S、Ge;Si和Ga,同一主族,Si在Ga上一周期,Si第一电离能大;Si、P、S为同一周期相邻元素,P元素原子的3p轨道为半充满,稳定性强,电子能量较低,P元素的第一电离能大,即第一电离能P>S>Si,所以第一电离能P>S>Si>Ga,因此P原子失去1个电子吸收的能量最多,答案选B。
考点:考查考查核外电子排布规律、电离能的比较

练习册系列答案
相关题目
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
下列叙述不正确的是
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其盐溶液的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
X、Y、Z、W是短周期元素,原子序数依次增大。X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同。下列说法正确的是
| A.X、Y形成的化合物只含有极性键 |
| B.X单质和Z单质在暗处能剧烈反应 |
| C.含W元素的盐溶液一定显酸性 |
| D.Z离子半径小于W离子半径 |
以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是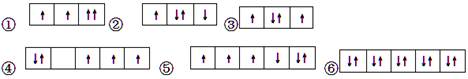
| A.① | B.①③ | C.②④⑤ | D.③④⑤ |
R为短周期元素,其原子所具有的电子层数为最外层电子数的一半。下列说法中不正确的是
| A.当它形成含氧酸根离子R2O42—时,也可以形成RO32— |
| B.当它形成含氧酸根离子RO42—时,还可以形成HRO3— |
| C.当它形成含氧酸根离子RO4—时,还可以形成RO3— |
| D.当它形成含氧酸根离子R2O72—时,也可以形成RO42— |
若某一个原子在处于能量最低状态时,外围电子排布为4d15s2,则下列各项说法正确的是
| A.该元素原子最外层共有3个电子 |
| B.该元素位于第5周期ⅡA族 |
| C.该元素原子核外第N层上共有9个不同状态的电子 |
| D.该元素原子第四电子层上有5个空轨道 |
A的原子结构示意图为: ,其基态原子的价电子层电子排布式正确的是
,其基态原子的价电子层电子排布式正确的是
| A.3s23p2 | B.3d24s2 | C.4s24p2 | D.3s23p4 |