题目内容
下列物质性质的变化规律中与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高;②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅;④NaF、NaCl、NaBr、NaI熔点依次降低
| A.仅③ | B.①③ | C.②④ | D.②③ |
D
解析试题分析:①F2、Cl2、Br2、I2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键的键能大小无关,故A错误;②HF、HI、HBr、HCl属于共价化合物,影响稳定性的因素是共价键,共价键的键能越大越稳定,与共价键的键能大小有关,但是HF,HC1,HBr,HI的热稳定性依次减弱,故②正确;③金刚石、晶体硅属于原子晶体,原子之间存在共价键,原子半径越小,键能越大,熔沸点越高,与共价键的键能大小有关且正确,故③正确;④NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,故④错误。故选D。
考点:本题考查晶体的熔沸点的比较,分子的稳定性,题目难度不大,注意晶体的类型以及影响晶体熔沸点高低的因素的判断。

练习册系列答案
相关题目
X、Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
| A.酸A中X的非金属性比酸B中Y的非金属性强 |
| B.酸A中X与酸B中Y在同一周期,且X在Y之后 |
| C.酸A与酸B的铵盐溶液反应生成酸B |
| D.酸A具有强氧化性,酸B没有强氧化性 |
不同元素的原子间最本质的区别是
| A.中子数不同 | B.相对原子质量不同 |
| C.质子数不同 | D.最外层电子数不同 |
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
下列叙述不正确的是
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其盐溶液的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
硫化氢分子中,形成共价键的原子轨道是
| A.硫原子的2p轨道和氢原子的1s轨道 |
| B.硫原子的2p轨道和氢原子的2p轨道 |
| C.硫原子的3p轨道和氢原子的1s轨道 |
| D.硫原子的2p轨道和氢原子的3p轨道 |
重水 是重要的核工业原料,下列关于D原子的说法错误的是
是重要的核工业原料,下列关于D原子的说法错误的是
A.氘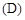 原子核外有1个电子 原子核外有1个电子 | B.是H的同位素 |
| C.自然界中没有D原子存在 | D.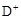 质量数为2 质量数为2 |
X、Y、Z、W是短周期元素,原子序数依次增大。X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同。下列说法正确的是
| A.X、Y形成的化合物只含有极性键 |
| B.X单质和Z单质在暗处能剧烈反应 |
| C.含W元素的盐溶液一定显酸性 |
| D.Z离子半径小于W离子半径 |
A的原子结构示意图为: ,其基态原子的价电子层电子排布式正确的是
,其基态原子的价电子层电子排布式正确的是
| A.3s23p2 | B.3d24s2 | C.4s24p2 | D.3s23p4 |