题目内容
15.氰气分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似.下列叙述正确的是( )| A. | 分子中含有2个σ键和4个π键 | |
| B. | 氰气不和氢氧化钠溶液发生反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 分子中的N≡C键的键长大于C-C键的键长 |
分析 A.1个单键就是1个σ键,1个双键中含有1个σ键1个π键,共价三键中含有1个σ键2个π键;
B.氰气性质与卤素相似;
C.氰气性质与卤素相似.
D.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长.
解答 解:A.1个单键就是1个σ键,1个双键中含有1个σ键1个π键,共价三键中含有1个σ键2个π键,所以氰气分子中含有3个σ键和4个π键,故A错误;
B.卤素单质能和氢氧化钠反应,氰气和卤素单质性质相同,所以氰气能和氢氧化钠溶液反应,故B错误;
C.卤素单质能和烯烃等发生加成反应,则氰气在一定条件下能与烯烃等发生加成反应,故C正确;
D.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C-C键的键长,故D错误;
故选C.
点评 本题考查了氰气的结构和性质,根据卤素单质的性质利用知识迁移的方法分析氰气的性质,难度不大.

练习册系列答案
相关题目
5.一种全天候太阳能电化学电池的工作原理如图所示.下列说法错误的是( )
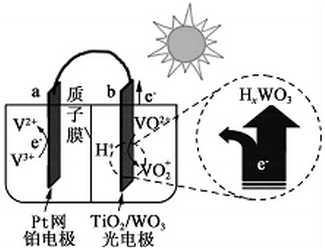

| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
6.下列说法正确的是( )
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | NaCl固体不导电,熔融的KCl能导电,所以前者是非电解质,而后者是电解质 | |
| C. | SO2、Na2O的水溶液都能导电,所以它们都是电解质 | |
| D. | 在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |
3.相同温度和压强下,1mol CO 和 1mol CO2相比较,下列说法不正确的是( )
| A. | 体积相同,但不一定是22.4 L | B. | 分子数相同,但原子数不同 | ||
| C. | 摩尔质量不同,氧原子个数相同 | D. | 质子数不同,电子数也不同 |
10.25℃时,有关物质的电离平衡常数如下:
(1)电解质由强至弱的顺序为H2SO3>CH3COOH>H2CO3(用化学式表示,下同).
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-、在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-、在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
5.实验室配制950mL 0.1mol/L的Na2CO3溶液时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A. | 1000mL,10.6g | B. | 1000mL,10.1g | C. | 950mL,10.1g | D. | 950mL,10.6g |
 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.