题目内容
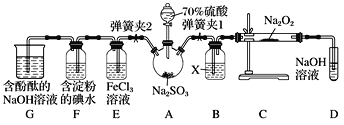
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式______________________________、________________________________。
(2)甲水浴的作用是_________________________________________;乙水浴的作用是_________________________________________。
(3)反应进行一段时间后,干试管a中能收集到不同的物质,它们是________。集气瓶中收集到的气体的主要成分是________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______。要除去该物质,可在混合液中加入____________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
【答案】2Cu+O2![]() 2CuO CH3CH2OH+CuO
2CuO CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 加热,使乙醇气化 冷却,使乙醛等液化 乙醛、乙醇、水 氮气 乙酸 c
CH3CHO+Cu+H2O 加热,使乙醇气化 冷却,使乙醛等液化 乙醛、乙醇、水 氮气 乙酸 c
【解析】
甲中鼓入空气,且在水浴加热条件下产生乙醇蒸汽,氧气和乙醇在铜催化下加热发生氧化还原反应生成乙醛和水,进入乙中的为乙醇、乙醛,在冷却下收集到乙醛,集气瓶收集氮气,据此解答。
(1)加热条件下铜和氧气反应生成氧化铜,氧化铜又氧化乙醇生成乙醛、铜和水,因此实验过程中铜网出现黑色和红色交替的现象,相应的化学方程式分别是2Cu+O2![]() 2CuO、CH3CH2OH+CuO
2CuO、CH3CH2OH+CuO![]() CH3CHO+Cu+H2O。
CH3CHO+Cu+H2O。
(2)常温下乙醇是液体,参加反应的是乙醇蒸汽,则甲水浴的作用是加热,使乙醇气化;生成物乙醛是液体,则乙水浴的作用是冷却,使乙醛等液化。
(3)由于是连续反应,乙醇不能完全被消耗,则反应进行一段时间后,干试管a中能收集到的物质是乙醛、乙醇、水。空气中含有氮气不参与反应,则集气瓶中收集到的气体的主要成分是氮气。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明显酸性,因此液体中还含有乙酸。四个选项中只有碳酸氢钠能与乙酸反应,则要除去该物质,可在混合液中加入碳酸氢钠溶液,答案选c。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】Ⅰ.已知:反应aA(g)+bB(g)cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L1·s1,则该反应的化学方程式为______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L1·s1;乙:v(B)=0.12 mol·L1·s1;丙:v(C)=9.6 mol·L1·min1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________(用甲、乙、丙表示)。
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(3)实验①的目的是_______________________________,实验中滴加FeCl3溶液的目的是____________________________。
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______________________________________________________________(用实验中所提供的几种试剂)。

(5)某同学在50 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如右图所示,则A、B、C三点所表示的即时反应速率最慢的是______。