题目内容
 (2011?杭州一模)有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质.为探究X的成分,设计方案并进行了如下实验:
(2011?杭州一模)有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质.为探究X的成分,设计方案并进行了如下实验:I.将X粉末充分加热,有气体产生.
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液.
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰.
Ⅳ,取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去.
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色.电解过程中测得溶液pH变化如
图所示.
(1)根据实验Ⅳ可判断,一定不存在的物质是
NaNO2
NaNO2
.(2)X的成分是
NaCl与NaHCO3
NaCl与NaHCO3
(填化学式).(3)实验V中,0~t时间内,两个电极上的电极反应式为:阳极
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
;阴极2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
.(4)0→t1时间内,溶液pH升高比较缓慢的原因是:
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
(用离子方程式表示).分析:I.将X粉末充分加热,有气体产生,可能含有碱式碳酸镁、碳酸氢钠;
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液,则一定不含有碱式碳酸镁;
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰,应含有钠盐;透过蓝色钴玻璃观察,无紫色火焰,说明不含有碳酸钾;
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去,说明不含有亚硝酸钠;
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,应生成氯气,说明含有氯化钠,电解过程后溶液pH不断增大,说明溶液碱性不断增强,以此解答该题.
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液,则一定不含有碱式碳酸镁;
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰,应含有钠盐;透过蓝色钴玻璃观察,无紫色火焰,说明不含有碳酸钾;
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去,说明不含有亚硝酸钠;
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,应生成氯气,说明含有氯化钠,电解过程后溶液pH不断增大,说明溶液碱性不断增强,以此解答该题.
解答:解:I.将X粉末充分加热,有气体产生,可能含有碱式碳酸镁、碳酸氢钠;
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液,则一定不含有碱式碳酸镁;
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰,应含有钠盐;透过蓝色钴玻璃观察,无紫色火焰,说明不含有碳酸钾;
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去,说明不含有亚硝酸钠;
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,应生成氯气,说明含有氯化钠,电解过程后溶液pH不断增大,说明溶液碱性不断增强,
(1)根据实验Ⅳ可判断,一定不存在的物质是NaNO2,因NaNO2具有还原性,可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,故答案为:NaNO2;
(2)由以上分析可知含有NaCl与NaHCO3,一定不含有碱式碳酸镁、碳酸钾、亚硝酸钠,因碳酸氢铵与硫酸铝发生互促水解而不能共存,则不含有硫酸铝,故答案为:NaCl与NaHCO3;
(3)溶液为氯化钠和碳酸氢钠混合溶液,电解时阳极发生2Cl--2e-=Cl2↑,阴极发生2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
(4)电解时阴极生成氢氧根离子,溶液中存在碳酸氢钠,则发生:HCO3-+OH-=CO32-+H2O,导致0→t1时间内,溶液pH升高比较缓慢,
故答案为:HCO3-+OH-=CO32-+H2O.
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液,则一定不含有碱式碳酸镁;
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰,应含有钠盐;透过蓝色钴玻璃观察,无紫色火焰,说明不含有碳酸钾;
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去,说明不含有亚硝酸钠;
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,应生成氯气,说明含有氯化钠,电解过程后溶液pH不断增大,说明溶液碱性不断增强,
(1)根据实验Ⅳ可判断,一定不存在的物质是NaNO2,因NaNO2具有还原性,可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,故答案为:NaNO2;
(2)由以上分析可知含有NaCl与NaHCO3,一定不含有碱式碳酸镁、碳酸钾、亚硝酸钠,因碳酸氢铵与硫酸铝发生互促水解而不能共存,则不含有硫酸铝,故答案为:NaCl与NaHCO3;
(3)溶液为氯化钠和碳酸氢钠混合溶液,电解时阳极发生2Cl--2e-=Cl2↑,阴极发生2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
(4)电解时阴极生成氢氧根离子,溶液中存在碳酸氢钠,则发生:HCO3-+OH-=CO32-+H2O,导致0→t1时间内,溶液pH升高比较缓慢,
故答案为:HCO3-+OH-=CO32-+H2O.
点评:本题考查较为综合,以未知物的检验为载体综合考查学生分析问题能力和知识的综合运用能力,题目侧重于物质的性质的考查,注意把握电解原理和盐类水解的规律,题目难度中等.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
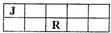 (2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
(2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )