题目内容
9.实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:玻璃棒、胶头滴管.
(2)根据计算得知,所需NaOH的质量为2.0g,应选用500mL容量瓶(填规格).
(3)定容时的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm;改用胶头滴管向容量瓶中滴加蒸馏水至液体凹液面最低处与刻度线相平为止.塞紧瓶塞,倒转摇匀并装试剂瓶.
(4)下列情况对所配制的溶液浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水无影响;
②所用过的烧杯、玻璃棒未洗涤偏小;
③加水超过刻度线后,用胶头滴管吸出多余的液体偏小.
分析 (1)根据配制溶液的实验操作过程选择所用仪器.
(2)根据n=cv计算氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)根据定容的操作来分析;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=分析判断;
解答 解:(1)没有450mL规格容量瓶,所以选用500mL容量瓶.
操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙.
根据提供的仪器可知,还需仪器有玻璃棒、胶头滴管.
故答案为:玻璃棒、胶头滴管.
(2)需氢氧化钠的质量为m=0.5L×0.1mol•L-1×40g/mol=2.0g;根据“大而近”的原则,根据需要配制的溶液的体积为450mL,但由于无450mL容量瓶,故应选择500mL容量瓶,故答案为:2.0g,500mL;
(3)定容时的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm时;改用胶头滴管向容量瓶中滴加蒸馏水至液体凹液面最低处与刻度线相平为止.塞紧瓶塞,倒转摇匀并装试剂瓶,故答案为:1-2cm,胶头滴管,液体凹液面最低处与刻度线相平;
(4)①只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,即容量瓶未干燥即用来配制溶液,对溶液浓度无影响,故答案为:无影响;
②所用过的烧杯、玻璃棒未洗涤,则导致溶质的损失,则浓度偏小,故答案为:偏小;
③加水超过刻度线后,用胶头滴管吸出多余的液体,则析出的不止是水,还有溶质,则浓度偏小,故答案为:偏小.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NO遇到空气变为红棕色 | |
| B. | NaCl溶液高温灼烧后呈现黄色 | |
| C. | SO2 通入到品红溶液中中使其褪色 | |
| D. | 含有色素的溶液加入活性炭后颜色褪去 |
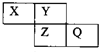 X、Y、Z、Q均为短周期元素,它们在周期表中位置如图所示.若X原子的最外层电子数是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中位置如图所示.若X原子的最外层电子数是内层电子数的2倍.下列说法中,正确的是( )| A. | 气态氢化物稳定性:Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Q比Z弱 | |
| C. | 非金属性比较:X>Y>Z | |
| D. | X与Q的化合物中含有共价键 |
| A. | NA个N2分子和NA个CO分子质量比为1:1 | |
| B. | 1 mol H2O的质量等于6.02×1023个H2O质量的总和 | |
| C. | 在任何条件下1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
| A. | Fe2+浓度增大,绿色变深 | B. | 加盐酸后体积增大,绿色变浅 | ||
| C. | 溶液变棕黄色 | D. | 溶液颜色基本不变 |
| A. | 18gH2O中含有的质子数为10NA | |
| B. | 7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.2NA | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失0NA个电子 |
| A. | 将322 gNa2SO4•10H2O溶于1L水中,所得溶液的物质的量浓度为1 mol•L-1 | |
| B. | 将1L2mol•L-1 H2SO4溶液加水稀释到2L,所得溶液的物质的量浓度为1mol•L-1 | |
| C. | 将1L18.4 mol•L-1的H2SO4溶液加入到1L水中,所得溶液的物质的量浓度为9.2mol•L-1 | |
| D. | 将336mLHCl气体溶于水,配成300mL溶液,所得溶液的物质的量浓度为0.05mol•L-1 |