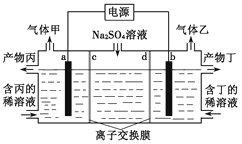
题目内容
【题目】不含共价键的离子化合物是
A.H2SO4B.Mg3N2C.NH4ClD.SiO2
【答案】B
【解析】
A.H2SO4是共价化合物,含有共价键,故A不选;
B.Mg3N2是离子化合物,只含离子键,不含共价键,故B选;
C.NH4Cl是离子化合物,含有离子键和共价键,故C不选;
D.SiO2是共价化合物,含有共价键,故D不选;
故选B。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】利用右图装置测定中和热的实验步骤如下: 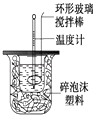
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,并测出其温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol): .
(2)倒入NaOH溶液的正确操作是 .
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)实验数据如表:
①请填写下表中的空白:
温度 | 起始温 | 终止温度t2/℃ | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=( 保留一位小数).
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D