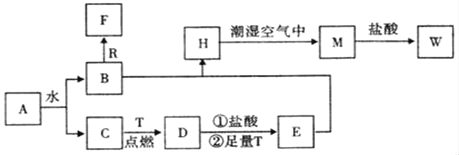
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
① | ||||||||
② | ③ | |||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④在周期表中的位置是______,③的最简单氢化物的电子式______。
(2)②、⑥、⑧对应的最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(3)①、②、③三种元素形成的化合物M中原子个数比为4∶2∶3,M中含有的化学键类型有______。
(4)能说明⑦的非金属性比⑧的非金属性______(填“强”或“弱”)的事实是______(用一个化学方程式表示)。
(5)⑤、⑧两元素最高价氧化物对应水化物相互反应的离子方程式为______。
【答案】第三周期IA族 ![]() HClO4 > HNO3 > H2SiO3 离子键和共价键 弱 Cl2 + H2S = 2HCl + S↓ Al(OH)3+3 H+=3H2O+Al3+
HClO4 > HNO3 > H2SiO3 离子键和共价键 弱 Cl2 + H2S = 2HCl + S↓ Al(OH)3+3 H+=3H2O+Al3+
【解析】
根据元素在周期表中的位置可知:①为H元素,②为N元素,③为O元素,④为Na元素,⑤为Al元素,⑥为Si元素,⑦为S元素,⑧为Cl元素,结合元素的性质以及元素周期律进行答题。
由分析可知:①为H元素,②为N元素,③为O元素,④为Na元素,⑤为Al元素,⑥为Si元素,⑦为S元素,⑧为Cl元素。
(1)由分析可知:④为Na元素,Na原子的核外有3个电子层,最外层有1个电子,故Na元素位于元素周期表的第三周期IA族;③为O元素,其最简单的氢化物为水,水分子中氢原子和氧原子之间形成共价键,电子式为:![]() ,故答案为:第三周期IA族,
,故答案为:第三周期IA族,![]() 。
。
(2)由分析可知:②为N元素,⑥为Si元素,⑧为Cl元素,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:Cl>N>Si,其对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2SiO3,故答案为:HClO4>HNO3>H2SiO3。
(3)由分析可知:①为H元素,②为N元素,③为O元素,种元素形成的化合物M中原子个数比为4∶2∶3,则M为NH4NO3,NH4NO3中既含离子键又含共价键,故答案为:离子键和共价键。
(4)由分析可知:⑦为S元素,⑧为Cl元素,同一周期从左向右,元素的非金属性逐渐增强,所以非金属性:Cl>S,可以通过单质间的置换反应比较非金属性强弱,反应方程式为:Cl2+H2S =2HCl +S↓,故答案为:弱,Cl2+H2S =2HCl +S↓。
(5)由分析可知:⑤为Al元素,⑧为Cl元素,其最高价氧化物对应水化物分别为Al(OH)3、HClO4,二者相互反应的离子方程式为:Al(OH)3+3H+=3H2O+Al3+,故答案为:Al(OH)3+3H+=3H2O+Al3+。

【题目】下列关于物质分类的正确组合是( )
分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | SO3 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D