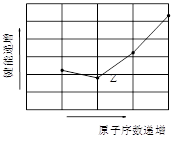
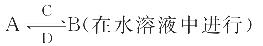题目内容
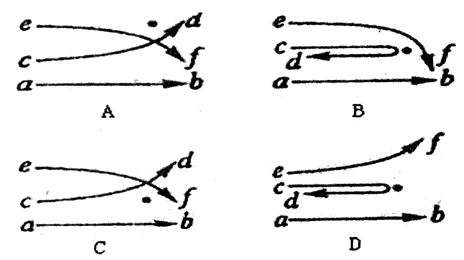
1911年前后,英国物理学家卢瑟福用带正电的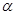 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的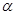 粒子的运动轨迹,能正确反映实验结果的图是( )
粒子的运动轨迹,能正确反映实验结果的图是( )
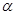 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的 粒子的运动轨迹,能正确反映实验结果的图是( )
粒子的运动轨迹,能正确反映实验结果的图是( )
D
试题分析:如果а粒子正撞原子核会反弹,如果а粒子撞到原子核的边缘会转向,如果а粒子没有撞到原子核会直接通过,符合这些现象的为D项。

练习册系列答案
相关题目