题目内容
13.下列离子方程式书写不正确的是( )| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑ | |
| C. | 氯气制漂白粉:2OH-+Cl2=Cl-+Cl0-+H2O | |
| D. | 氯气和水反应:Cl2+H2O=H++Cl-+HClO |
分析 A.反应生成碘和氯化钾;
B.反应生成氯化锰和氯气、水;
C.氯气通入石灰乳制备漂白粉,石灰乳时,氢氧化钙应保留化学式;
D.反应生成氯化氢和次氯酸.
解答 解:A.氯水和碘化钾反应,离子方程式:Cl2+2I-=2Cl-+I2,故A正确;
B.二氧化锰和盐酸制氯气,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,故B正确;
C.氯气制漂白粉,离子方程式:2Cl2+2Ca(OH)2=2Ca2++2Cl-+2ClO-+2H2O,故C错误;
D.氯气和水反应,离子方程式:Cl2+H2O=H++Cl-+HClO,故D正确;
故选:C.
点评 本题离子方程式的书写,明确发生的反应是解答本题的关键,注意微溶物在书写离子方程式时拆分原则,题目难度不大,

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
5.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.下列叙述正确的是( )

| A. | 银片为正极,发生的反应为:Ag++e-=Ag | |
| B. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| C. | 取下盐桥,原电池仍可工作 | |
| D. | 在外电路中,电子从正极流向负极 |
18.长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列.按这种规定,下列说法正确的是( )
| A. | 第15列元素原子的最外层电子排布为ns2 np5 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第9列元素是铁元素 | |
| D. | 第9列中元素中没有非金属元素 |
3.下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
| 编号 | 金属(粉末状)物质的量 | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg 0.1mol | 0.1 6 mol•L-1硝酸10mL | 80 |
| B | Mg 0.1mol | 0.1 3 mol•L-1 盐酸10mL | 60 |
| C | Fe 0.1mol | 0.1 3 mol•L-1盐酸10mL | 60 |
| D | Mg 0.1mol | 0.1 3 mol•L-1硫酸10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |

 可简写为
可简写为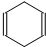 .现有某化合物W的分子结构可表示为:
.现有某化合物W的分子结构可表示为: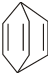 .
.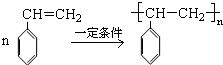 .
.