题目内容
【题目】已知温度T时,水的离子积常数为Kw,该温度下,将浓度为a molL﹣1的一元酸HA溶液与b molL﹣1的一元碱BOH溶液等体积混合,可判断该溶液一定呈中性的依据是( )
A.混合溶液的PH=7
B.混合溶液中,C(H+)= ![]() mol?L﹣1
mol?L﹣1
C.a=b
D.混合溶液中,C(H+)+C(B+)=C(OH﹣)+C(A﹣)
【答案】B
【解析】解:A.因温度未知,则pH=7不一定为中性,故A错误;B.混合溶液中,c(H+)= ![]() mol/L,根据c(H+)c(OH﹣)=KW , 可知溶液中c(H+)=c(OH﹣)═
mol/L,根据c(H+)c(OH﹣)=KW , 可知溶液中c(H+)=c(OH﹣)═ ![]() mol/L,溶液呈中性,故B正确;
mol/L,溶液呈中性,故B正确;
C.因酸碱的强弱未知,a=b,只能说明酸碱恰好完全反应,但如为强酸弱碱盐或强碱弱酸盐,则溶液不呈中性,故C错误;
D.任何溶液都存在电荷守恒,即c(H+)+c(B+)=c(OH﹣)+c(A﹣),不能确定溶液的酸碱性,故D错误.
故选B.

【题目】实验室用少量的溴水和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示: 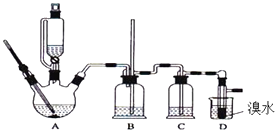
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请回答下列问题:
(1)写出制备1,2二溴乙烷的反应原理方程式:、
(2)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是(填序号).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是 .
(4)在装置C中应加入(填序号),其目的是吸收反应中可能生成的酸性气体.
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是 .
(6)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在(填“上”或“下”)层.
(7)若产物中有少量副产物乙醚,可用的方法除去.






