��Ŀ����
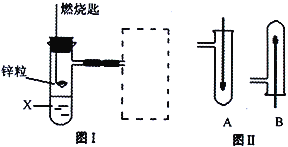
����Ŀ��ʵ��������������ˮ���������Ҵ��Ʊ�1��2�����������װ����ͼ��ʾ�� 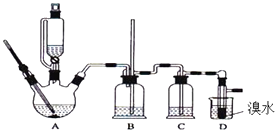
�Ҵ� | 1��2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
��ش��������⣺
��1��д���Ʊ�1��2��������ķ�Ӧԭ������ʽ����
��2���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶����ߵ�170�����ң�����Ҫ��Ŀ����������ţ���
a��������Ӧ b���ӿ췴Ӧ�ٶ�c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��3��װ��B�������� ��
��4����װ��C��Ӧ����������ţ�����Ŀ�������շ�Ӧ�п������ɵ��������壮
a��ˮb��Ũ����c������������Һd������̼��������Һ
��5���жϸ��Ʊ���Ӧ�Ѿ�������������� ��
��6����1��2��������ֲ�Ʒ���ڷ�Һ©���У���ˮ���ã�����Ӧ������ϡ����¡����㣮
��7�������������������������ѣ������ķ�����ȥ��
���𰸡�
��1��CH3CH2OH ![]() CH2=CH2��+H2O��CH2�TCH2+Br2��BrCH2CH2Br
CH2=CH2��+H2O��CH2�TCH2+Br2��BrCH2CH2Br
��2��d
��3���ж�װ���Ƿ����
��4��c
��5��D����ˮ����ɫ��ȫ��ȥ
��6����
��7������
���������⣺��1���Ʊ�1��2��������ķ�Ӧԭ������ʽ��CH3CH2OH ![]() CH2=CH2��+H2O��CH2�TCH2+Br2��BrCH2CH2Br���Դ��ǣ�CH3CH2OH
CH2=CH2��+H2O��CH2�TCH2+Br2��BrCH2CH2Br���Դ��ǣ�CH3CH2OH ![]() CH2=CH2��+H2O�� CH2�TCH2+Br2��BrCH2CH2Br����2���Ҵ���Ũ����140��������£�������������ˮ�������ѣ�����Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ���ǣ����ٸ������������ɣ�
CH2=CH2��+H2O�� CH2�TCH2+Br2��BrCH2CH2Br����2���Ҵ���Ũ����140��������£�������������ˮ�������ѣ�����Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ���ǣ����ٸ������������ɣ�
���Դ��ǣ�d����3�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г�������E������Ϊ�ж�װ���Ƿ������
���Դ��ǣ��ж�װ���Ƿ��������4��Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ���CH3CH2OH+4H2SO4��Ũ�� ![]() 4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��������̼��ˮ���ܽ��С��������ز������ն�����̼��Ũ����Ȳ������ն�����̼��Ҳ�������ն�����������̼�����������ܺ�����������Һ��Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O��
4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��������̼��ˮ���ܽ��С��������ز������ն�����̼��Ũ����Ȳ������ն�����̼��Ҳ�������ն�����������̼�����������ܺ�����������Һ��Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O��
���Դ��ǣ�c����5��Һ��Ϊ����ɫ������1��2����������Ϊ��ɫ������Ӧ����ʱҺ��ȫ��ת��Ϊ1��2���������飬D��Һ���ɺ���ɫ��Ϊ��ɫ
���Դ��ǣ�D����ˮ����ɫ��ȫ��ȥ����6��1��2�����������ˮ�����ܣ�1��2�����������ܶȱ�ˮ�����Լ�ˮ�����ã�����Ӧ���²㣬
���Դ��ǣ��£���7��1��2���������������ѵķе㲻ͬ�����߾�Ϊ�л�����ܣ�������ķ��������Ƿ��룬
���Դ��ǣ�����

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�