��Ŀ����
����Ŀ����1��ʵ������ȡ���������ռ������漰���¼�����Ҫ�Σ�

��������3���Լ���A������ʳ��ˮ B��NaOH��Һ C.Ũ����
���������Լ���ѡ����գ�
��X��Y��Һ�ֱ�Ӧѡ��______���A������B����C������
��β�����������У��������������______���A������B����C�������ա�
��2��ij��ѧ��ȤС��Ϊ��̽��Cl2��������ʣ���������µ�ʵ�顣

��д��Cl2��ˮ��Ӧ�����ӷ���ʽ______��
��ͨ��Cl2�Ӽ���ƿA��B������ɵó��Ľ�����______��
��3����ͼ��ʾ������ʵ������У����������������______��д����ӦA�Ļ�ѧ����ʽ______��

��4�����������в���ȱ�ٵ���Ԫ�أ���ȱ������Ŀǰ��֪�ĵ������������ϰ�����Ҫԭ���ҹ���ʳ���м����Ԫ������Ч��ֹȱ������ļ�����

ijͬѧ������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ������������ͼ��
�ף�������ȡ�������ң����÷ֲ��������
�ٸ�ͬѧ�����õ���ȡ��������______���A������B����C������
A���ƾ� B����C�����Ȼ�̼
�ڼס��ҡ���3��ʵ������У�����ȷ����______����ס������ҡ���������
���𰸡� A C B Cl2+H2O�TH++Cl-+HClO Cl2��Ư����HClO��Ư���� C 2HClO�T2HCl+O2�� C ��
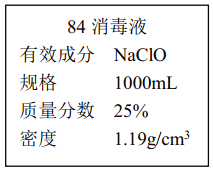
����������1����Ũ��������ӷ��ԣ��Ʊ��������к����Ȼ����ˮ�����������Ȼ��⼫������ˮ�������ڱ���ʳ��ˮ���ܽ�Ȳ�������X��ҺΪ����ʳ��ˮ����ѡA��Ũ���������ˮ��ѡ����ʵij��Ӽ�������YΪŨ���ᣬ��ѡC����β�����������У��������������NaOH��Һ���գ���ѡB����2����Cl2��ˮ��Ӧ�����Ȼ���ʹ����ᣬ��Ӧ�����ӷ���ʽ����ʽΪ��Cl2+H2O![]() H++Cl-+HClO����ͨ��Cl2��A�и��ﲼ������ɫ��B��ʪ������ɫ����֤������������Ư���ԣ����������Ư���ԣ���3��A��������ȶ������������£��������ֽ����������������B�����ͷ۵���Ҫ�ɷ���̼�����ƣ�̼�����ƺ����ᷴӦ���ɶ�����̼��C���������ƺ����������ᶼ���ɿ����Ե��κ�ˮ��û�����������D��Ũ����Ͷ��������ڼ����������ܷ�Ӧ������������ѡC����ӦA�Ǵ������ڹ��������·ֽ������������������Ӧ�Ļ�ѧ����ʽΪ��2HClO
H++Cl-+HClO����ͨ��Cl2��A�и��ﲼ������ɫ��B��ʪ������ɫ����֤������������Ư���ԣ����������Ư���ԣ���3��A��������ȶ������������£��������ֽ����������������B�����ͷ۵���Ҫ�ɷ���̼�����ƣ�̼�����ƺ����ᷴӦ���ɶ�����̼��C���������ƺ����������ᶼ���ɿ����Ե��κ�ˮ��û�����������D��Ũ����Ͷ��������ڼ����������ܷ�Ӧ������������ѡC����ӦA�Ǵ������ڹ��������·ֽ������������������Ӧ�Ļ�ѧ����ʽΪ��2HClO![]() 2HCl+O2������4������ȡ����ԭ�ܼ������ܣ����ʺ���ȡ������Ӧ������������ȡ���е��ܽ�ȴ�����ԭ�ܼ��е��ܽ�ȣ����ʺ���������ȡ�����б������Ȼ�̼���ٽ��ͼ����Ϣ��֪�л������²㣬��ȡ�����ܶȴ���ˮ����Ӧѡ���Ȼ�̼����ѡC�����ס��ҡ���3��ʵ������У�����ȷ���DZ�����Һʱ�����²���Һ���¿ڷų����ϲ���Һ���Ͽڵ�����
2HCl+O2������4������ȡ����ԭ�ܼ������ܣ����ʺ���ȡ������Ӧ������������ȡ���е��ܽ�ȴ�����ԭ�ܼ��е��ܽ�ȣ����ʺ���������ȡ�����б������Ȼ�̼���ٽ��ͼ����Ϣ��֪�л������²㣬��ȡ�����ܶȴ���ˮ����Ӧѡ���Ȼ�̼����ѡC�����ס��ҡ���3��ʵ������У�����ȷ���DZ�����Һʱ�����²���Һ���¿ڷų����ϲ���Һ���Ͽڵ�����

 ������������ϵ�д�
������������ϵ�д�