题目内容
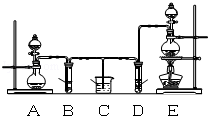
【题目】一定温度下,在恒容的密闭容器中加入1 mol N2和3 mol H2发生反应:N2+3H2![]() 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是
A.充分反应后,可得到2 mol NH3
B.压强不变时,达到该反应的最大限度
C.达到平衡状态时,v (正)与v (逆)均为零
D.达到平衡状态时,N2、 H2、NH3 物质的量浓度之比一定为1:3:2
【答案】B
【解析】
根据可逆反应和化学平衡状态的特征解答。
A.该反应为可逆反应,1 mol N2和3 mol H2不能完全反应,生成的NH3的物质的量小于2 mol ,A错误;
B.该反应的正反应是一个气体体积减小的反应,在反应过程中压强会不断的减小,当压强不变时,反应达到平衡状态,即达到该反应的最大限度,B正确;
C.化学平衡是动态平衡,当可逆反应达到平衡状态时,反应仍在进行,v (正)与v (逆)相等但不为零,C错误;
D.达到平衡状态时,N2、 H2、NH3 物质的量浓度之比与各物质的初始浓度及反应物的转化率有关,可能等于1:3:2,也可能不等于1:3:2,D错误。
答案选B。

 全能测控一本好卷系列答案
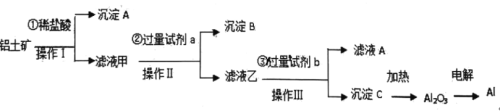
全能测控一本好卷系列答案【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
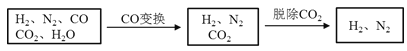
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
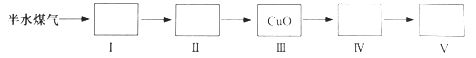
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。