题目内容
【题目】电导率可用于衡量电解质溶液导电能力的大小。向一定浓度的![]() 溶液中滴入某浓度的
溶液中滴入某浓度的![]() 溶液,其电导率随滴入的
溶液,其电导率随滴入的![]() 溶液体积的变化如图所示。下列说法不正确的是( )
溶液体积的变化如图所示。下列说法不正确的是( )
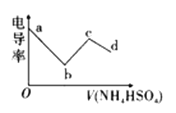
A. bc段的离子方程式为:![]()
B. c点溶液中:![]()
C. bc段之间存在某点,其溶液中:![]()
D. b点溶液存在三个平衡,且水的电离被抑制
【答案】B
【解析】
根据导电能力随滴入溶液体积的变化如图可知,b点时导电能力最弱,则n(NH4HSO4)=n[Ba(OH)2],该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3·H2O+H2O,该点溶液中的溶质为NH3·H2O;c点时导电能力最强,n(NH4HSO4)=2n[Ba(OH)2],该点溶液中发生的反应为2NH4HSO4+Ba(OH)2=BaSO4↓+(NH4)2SO4+2H2O,该点溶液中溶质为 (NH4)2SO4,(NH4)2SO4是强酸弱碱盐;据此分析解答.
A、ab段电导率一直在下降,因此溶液中自由移动的离子浓度在减小,起始阶段,由于![]() 过量,所以发生的反应就是NH4HSO4+Ba(OH)2=BaSO4↓+NH3·H2O+H2O,
过量,所以发生的反应就是NH4HSO4+Ba(OH)2=BaSO4↓+NH3·H2O+H2O,![]() ,b点时溶液的溶质为
,b点时溶液的溶质为![]() ,bc段为
,bc段为![]() 和
和![]() 的反应,产物为
的反应,产物为![]() ,故A正确;
,故A正确;
B、从b点到c点,溶液的电导率在增大,此时![]() 过量,发生的反应为:
过量,发生的反应为:![]() ,溶液的溶质是
,溶液的溶质是![]() ,根据电荷守恒:
,根据电荷守恒:![]() ,因为
,因为![]() ,所以
,所以![]() ,故B错误;
,故B错误;
C、从b点到c点的过程中,溶液由碱性变为酸性,所以可为中性,因此根据电荷守恒,![]() ,故C正确;
,故C正确;
D、b点时溶液中存在着![]() 的电离平衡、
的电离平衡、![]() 的溶解平衡和水的电离平衡,
的溶解平衡和水的电离平衡,![]() 的存在抑制了水的电离,故D正确;
的存在抑制了水的电离,故D正确;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D