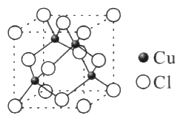
题目内容
按要求回答下列问题:
(1)硫酸铜水溶液中含有的水合铜离子化学式为________。向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,生成深蓝色的配合离子化学式为________,再向反应后的溶液中加入乙醇,析出的深蓝色晶体的化学式为________。
(2)试比较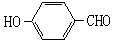 和
和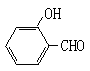 的沸点高低并说明理由_________。
的沸点高低并说明理由_________。
(1)[Cu(H2O)4] 2+ (2分) [Cu(NH3)4] 2+ (2分) [Cu(NH3)4]SO4·H2O(2分)
(2)前者形成分子间氢键,而后者形成分子内氢键,分子间氢键使分子间的作用力增大,所以 的沸点比
的沸点比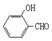 高。(2分)
高。(2分)
解析试题分析: (1)在电解质溶液里,离子跟水分子结合生成的带电微粒,叫水合离子。有些离子与水结合得比较牢固,而且结合的水分子有一定的数目,以络离子的形式存在,例如[Cu(H2O)4],向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,其反应方程式为:CuSO4+2NH3·H2O=Cu(OH)2↓+(NH4)2SO4
Cu(OH)2+4NH3·H2O = [Cu(NH3)4)](OH)2+4H2O。加乙醇因为[Cu(NH3)4]SO4在乙醇中的溶解度很小,会以晶体形式析出。
(2)者形成分子间氢键,而后者形成分子内氢键,分子间氢键使分子间的作用力增大,所以 的沸点比
的沸点比 高。
高。
考点:

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案近年来研制的NF3气体可用作氟化氢—氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2=NF3+3NH4F,下列说法中不正确的是( )
A.NF3的形成过程用电子式可表示为 |
| B.NF3分子空间构型为三角锥形 |
| C.NF3的氧化性大于F2 |
| D.NH4F中既有离子键又有极性共价键 |
过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口及环境、食品消毒;实验室一般用过氧化钡(BaO2)与稀硫酸反应来制取。请问,过氧化钡(BaO2)中所含化学键为
| A.只有离子键 | B.离子键和共价键 |
| C.只有共价键 | D.离子键、共价键和氢键 |

 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是