题目内容
【题目】
(1)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量(填“大于”、“等于”或“小于”)途径II放出的热量。
②b 与a、c、d的数学关系式是 。
(2)甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
则H2和CO制液态甲醇的热化学方程式为。
(3)如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.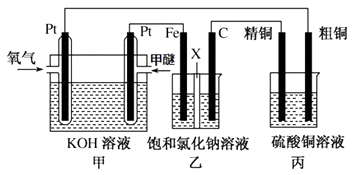
报据要求回答相关问题:
①写出甲中通甲醚一极的电极反应式。
②乙中发生的总反应的离子方程式为。
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,用惰性电极电解一段时间后,某一电极上析出了0.3mol Cu,此时在另一电极上产生的气体体积(标准状况)为 L,若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为g 。
【答案】
(1)等于,b= ![]() +
+ ![]() -a
-a
(2)CO(g)+2H2(g)=CH3OH(l) △H=-129.6kJ/mol
(3) CH3OCH3 -12e- + 16OH- = 2CO32-+ 11H2O,2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-,5.6,35
Cl2↑+H2↑+2OH-,5.6,35
【解析】(1)①根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,所以途径I放出的热量等于途径II放出的热量;
②途径I:①C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:②C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
③2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
④2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
反应①=反应②+反应③× ![]() +反应④×
+反应④× ![]() ,所以-a=b+
,所以-a=b+ ![]() (-c-d),所以b=-a+
(-c-d),所以b=-a+ ![]() (c+d);
(c+d);
(2)① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
根据盖斯定律,②× ![]() +③-①×
+③-①× ![]() 得H2和CO制液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-129.6kJ/mol;
得H2和CO制液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-129.6kJ/mol;
(3)①甲醚燃料电池,甲醚在负极失电子生成碳酸根离子和水,电极反应式是CH3OCH3 -12e- + 16OH- = 2CO32-+ 11H2O;
②乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨是阳极,阳极上氯离子放电生成氯气,阴极上是水电离的氢离子放电生成氢气,总反应是2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2 mol KNO3、0.4 mol Cu(NO3)2和0.4 mol KCl。用惰性电极电解,析出了0.3mol Cu,阴极反应是:Cu2++2e-=Cu,阴极生成铜0.3mol,阴极转移电子的总物质的量是0.3×2=0. mol;阳极先后发生反应有2Cl--2e-=Cl2、4OH--4e-=2H2O+O2、;溶液中共0.4mol Cl-,阳极生成氯气0.2mol,设生成氧气xmol,根据电子守恒,4x+0.4=0.6,则x=0.05mol,所以生成气体的体积(0.2+0.05)mol×22.4L/mol=5.6L 。若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为0.3mol×64g/mol+0.2mol×71g/mol+0.05×32g/mol=35g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②