题目内容
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析不正确的是( ) 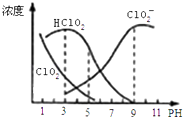
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
【答案】C
【解析】解:A、由图可以得出:碱性条件下ClO2﹣浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B、HClO2的电离平衡常数K= ![]() =10﹣3×10﹣3=10﹣6 , 故B正确;
=10﹣3×10﹣3=10﹣6 , 故B正确;
C、HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度越大即为使用该漂白剂的最佳pH,应该是4﹣5,故C错误;
D、依据电中性原则得出:c(H+)+c(Na+)=c(ClO2﹣)+c(OH﹣) ①,依据物料守恒得出:2c(Na+)=c(ClO2﹣)+c(HClO2) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣),故D正确,
故选C.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

【题目】恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g).反应过程中测定的部分数据如表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是( )
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(Lmin)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol