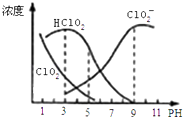
��Ŀ����
����Ŀ������˵������ȷ���ǣ� ��
A.ij�¶��£�ˮ�����ӻ�����Kw=10��13 �� �ڴ��¶��£���pH=12��NaOH��ҺVa L��pH=2������Vb L��ϣ�������Һ�����ԣ���Va��Vb=1��10
B.��֪�������ƽ�ⳣ��ΪKa�������ˮ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw�������߹�ϵΪKaKh=Kw
C.�����£�pH=1��ǿ����Һ����ˮϡ�ͺ���Һ�и�����Ũ�Ⱦ�����
D.�ס�������Һ����ǿ����ʣ���֪����Һ��pH������ҺpH����������ס�������Һ�������ϣ����ҺpH���ܵ���7
���𰸡�C
���������⣺A��ij�¶��£�ˮ�����ӻ�����Kw=10��13 �� �ڴ��¶��£���pH=12��NaOH��Һ����������Ũ��Ϊ0.1mol/L��pH=2��������Һ�������ӵ�Ũ��Ϊ0.01mol/L����Ϻ������ԣ���n��OH����=n��H+�������У�0.1mol/L��Va L=0.01mol/L��Vb L�����У�Va��Vb=1��10����A��ȷ��
B��ˮ��͵���Ϊ������̣�Ka= ![]() ��Kb=
��Kb= ![]() ������KaKh=Kw �� ��B��ȷ��
������KaKh=Kw �� ��B��ȷ��
C��ǿ����Һȫ�����룬��ˮϡ�ͺ���Һ��H+����Ũ��һ�������͵�����������Ũ������C����
D����pH֮�͵���14ʱ������ҺpH=7����D��ȷ��
��ѡC��
�����㾫�����������������ˮ��Һ�еĵ���ƽ���ǽ����ĸ�������Ҫ֪����������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����

 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�