题目内容
【题目】铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al2O3(s)+AlCl3(g)+3C(s)![]() 3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al2O3冶铝的部分反应如下:
Ⅰ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1=akJ/mol
Ⅱ. 4Al2O3(s)+Al4C3(s)=3Al4O4C(s) △H2=bkJ/mol
Ⅲ. Al4O4C(s)+Al4C3(s)=8Al(g)+4CO(g) △H3=ckJ/mol
反应Al2O3(s)+3C(s)=2Al(g)+3CO(g)的△H=__________kJ/mol
③用离子液体AICb-BMIC(阳离子为EMIM+、阴离子为AlCl4-、Al2Cl7-)作电解质,可实现电解精炼铝。粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al、Fe或Al-Fe合金还原脱除水体中的硝态氮(NO3--N),在45℃,起始c(KNO3-N)为50mg·L-1、维持溶液呈中性并通入Ar等条件下进行脱除实验。结果如图所示(c0为起始浓度、c为剩余浓度):
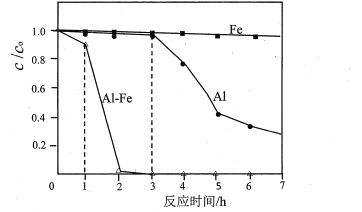
①纯Al在0~3h时,NO3-几乎没有被脱除,其原因是_______________________;写出3h后NO3-被还原为N2的离子方程式:____________________________。
②Al-Fe合金1~2h比纯A13~4h的脱除速率快得多的可能原因是________________。
【答案】![]()
![]() 正 4Al2Cl7-+3e- = 7AlCl4-+Al 3Li5AlO4 + 5Al
正 4Al2Cl7-+3e- = 7AlCl4-+Al 3Li5AlO4 + 5Al ![]() 15Li(g) + 4Al2O3 铝表面的氧化膜仍未被溶解 10Al + 6NO3-+ 12H2O + 6H+
15Li(g) + 4Al2O3 铝表面的氧化膜仍未被溶解 10Al + 6NO3-+ 12H2O + 6H+![]() 10Al(OH)3 + 3N2↑ Al-Fe形成原电池能加速电子转移
10Al(OH)3 + 3N2↑ Al-Fe形成原电池能加速电子转移
【解析】
(1)①平衡常数表达式为生成物浓度幂之积与反应物浓度幂之积的比值;
②利用盖斯定律去反应热;
③电解精炼时,粗铝作阳极,而阴极上生成Al;
(3)②Al、Fe的活泼性不同,在溶液中可以构成原电池,加快反应速率。
(1)①平衡常数表达式为生成物浓度幂之积与反应物浓度幂之积的比值,固体的浓度为定值,不出现在表达式中,则平衡常数![]() ;
;
②根据盖斯定律,反应Ⅰ×![]() +反应Ⅱ×
+反应Ⅱ×![]() +反应Ⅲ×
+反应Ⅲ×![]() 可得目标反应Al2O3(s)+3C(s)=2Al(g)+3CO(g),则△H=△H1×
可得目标反应Al2O3(s)+3C(s)=2Al(g)+3CO(g),则△H=△H1×![]() +△H2×
+△H2×![]() +△H3×
+△H3×![]() kJ/mol
kJ/mol
=![]() kJ/mol;
kJ/mol;
③电解精炼中,含有杂质的金属作阳极,失去电子,形成离子进入电解质中,在阴极得到电子得到单质,从而完成冶炼过程,因此粗铝与外电源的正极相连;电解质溶液中Al以AlCl4-、Al2Cl7-的形式存在,在阴极得到电子,生成Al,电极方程式为4Al2Cl7-+3e-=7AlCl4-+Al;
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂,Al则转化为Al2O3,化学方程式为3Li5AlO4+5Al![]() 15Li(g)+4Al2O3;
15Li(g)+4Al2O3;
(3)①纯Al在0~3h,NO3-几乎没有被脱除,说明几乎没有反应,而在3h后,反应才开始,可能是由于Al的表面有一层氧化膜,阻止了反应的进行,因此纯Al在0~3h时,NO3-几乎没有被脱除,其原因是铝表面的氧化膜仍未被溶解;Al和NO3-反应,溶液是中性的,产物中Al以Al(OH)3的形式存在,Al的化合价从0升高到+3价,NO3-中N的化合价从+5价降低到0价,根据化合价升降守恒,Al和NO3-的系数比为5:3,再根据电荷守恒和原子守恒,可得离子方程式为10Al+6NO3-+12H2O+6H+![]() 10Al(OH)3+3N2↑;
10Al(OH)3+3N2↑;
②Al、Fe的活泼性不同,在溶液中可以构成原电池,加快电子转移,加快了反应速率。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |