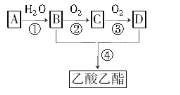
题目内容
【题目】乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O![]() NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
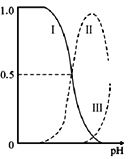
A. 曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+
B. 曲线Ⅰ与曲线II相交点对应pH=6.85
C. 乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-
[H3NCH2CH2NH3]2++OH-
D. 0.1 mol/LH2NCH2CH2NH3Cl溶液中各离子浓度大小关系为:c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-)
【答案】D
【解析】
A.乙二胺(H2NCH2CH2NH2),水溶液中分步电离,第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-,第二步电离:H2NCH2CH2NH3++H2O
H2NCH2CH2NH3++OH-,第二步电离:H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-,pH越小,有利于电离平衡正向移动,[H3NCH2CH2NH3]2+的浓度越大,则曲线Ⅰ代表的是[H3NCH2CH2NH3]2+,曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+,A正确;
[H3NCH2CH2NH3]2++OH-,pH越小,有利于电离平衡正向移动,[H3NCH2CH2NH3]2+的浓度越大,则曲线Ⅰ代表的是[H3NCH2CH2NH3]2+,曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+,A正确;
B.曲线Ⅱ代表的是H2NCH2CH2NH3+,曲线Ⅰ[H3NCH2CH2NH3]2+与曲线Ⅱ相交点处和H2NCH2CH2NH3+浓度相同,c(OH-)=Kb2=10-7.15,c(H+)=![]() =10-6.85,所以溶液的pH=6.85,B正确;
=10-6.85,所以溶液的pH=6.85,B正确;
C.乙二胺(H2NCH2CH2NH2)是无色液体,有类似氨的性质,已知:25℃时,kb1=10-4.07,kb2=10-7.15;属于二元弱碱,其水溶液显弱碱性,则H2NCH2CH2NH2在水溶液中第二步电离的方程式为:H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-,C正确;
[H3NCH2CH2NH3]2++OH-,C正确;
D.在0.1mol/LH2NCH2CH2NH3Cl溶液中H2NCH2CH2NH3+离子水解溶液显酸性,电离使溶液显碱性,由于电离大于水解,因此该溶液显碱性,溶液中离子浓度大小为:c(Cl-)>c(H2NCH2CH2NH3+)>c(OH-)>c(H+),D错误;
故合理选项是D。

【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
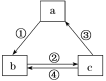
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D