题目内容
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
【答案】HF CaCO3、Al(OH)3 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 该反应的 K=3.5×105,可以认为该反应进行完全 冷却结晶 过滤洗涤 6HF+Na2SO4+NaAlO2=Na3AlF6+H2SO4+2H2O 负 2Cl--2e-=Cl2↑ 氯气
【解析】
含锂电解铝废渣主要成分为LiF、AlF3、NaF,少量CaO等,加入浓硫酸生成的气体为HF,浸取后过滤分离出滤渣为CaSO4,滤液中加碳酸钠发生2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑、2Li++CO32-=Li2CO3,气体为二氧化碳,过滤分离出滤液含硫酸钠,分离出氢氧化铝、Li2CO3,再加CaO、苛化反应将不溶性的碳酸锂转化成氢氧化锂溶液,过滤分离出滤渣2含碳酸钙,碳化时LiOH与二氧化碳反应生成Li2CO3,二氧化碳在流程中可循环使用,以此来解答。
(1)根据上述分析,废渣与浓硫酸反应产生的气体化学式为HF,根据上述分析,滤渣2的主要成分是CaCO3、Al(OH)3,故答案为:HF;CaCO3、Al(OH)3;
(2)碱解反应中,同时得到气体和沉淀反应是铝离子与碳酸根离子的双水解反应,离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(3)Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)的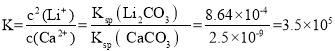 >105,可以认为该反应进行完全,故答案为:该反应的 K=3.5×105,可以认为该反应进行完全;
>105,可以认为该反应进行完全,故答案为:该反应的 K=3.5×105,可以认为该反应进行完全;
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、冷却结晶、过滤洗涤、干燥,故答案为:冷却结晶、过滤洗涤;
(5)根据流程图知,反应物为HF、Na2SO4、NaAlO2,生成物为Na3AlF6,根据原子守恒及反应原理书写方程式为:6HF+Na2SO4+NaAlO2=Na3AlF6+H2SO4+2H2O,故答案为:6HF+Na2SO4+NaAlO2=Na3AlF6+H2SO4+2H2O;
(6)根据图示C极有Li生成,电极反应为:Li++ e-=Li,则C为阴极,发生还原反应,应连接电源的负极;阳极发生氧化反应,根据图示阳极有氯气生成,则电极反应式为:2Cl--2e-=Cl2↑;根据图示分析,该方法设计的 A 区能用熔融的碳酸锂吸收产生的氯气,防止氯气对还原产生污染,故答案为:负; 2Cl--2e-=Cl2↑;氯气。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D