题目内容
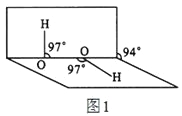
【题目】(1)已知食盐常加入KIO3 来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)。
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为___L。
【答案】1 5 3 3 3 3 BCD 0.12mol 22.4
【解析】
本题主要考察氧化还原反应。
(1)利用得失电子守恒,配平该化学方程式为:![]() ;
;
①相当于利用上述反应检验KIO3,则需要反应物KI和H2SO4,反应后,用淀粉溶液检验I2的存在,说明该反应发生了,所以需要试剂BCD;
②由该方程式可知,生成3mol I2需要转移5mol电子,所以转移0.2mol电子,生成I2有0.12mol;
(2)由该方程式可知,8份NH3中,有2份作还原剂,6份作碱;所以1.5mol Cl2氧化1mol NH3,即被氧化的NH3的体积为22.4L(标况)。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2、LiFePO4、LiMnO2、Cu与磷的化合物等都是研究电池的常用材料。请回答下列问题。
(1)Co4+中存在__种不同能量的电子。
(2)你预测第一电离能:Cu__Zn(填“>”或“<”)。请说出你的理由:__。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
表格中卤化物的熔点产生差异的原因是:___。
(4)直链多磷酸盐的阴离子有复杂的结构,焦磷酸根离子、三磷酸根离子结构如图:

这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(5)钴蓝晶胞结构如图1所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成如图2,则钴蓝晶体的化学式为___。在晶体中,某些原子位于其它原子围成的空隙中,如图3中●原子就位于最近的4个原子围成的正四面体空隙中。在钴蓝晶体中,Al3+位于O2-形成的___空隙中。若阿伏加德罗常数用NA表示,则钴蓝晶体的密度为___g·cm-3(列计算式即可,不必化简)。

【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D