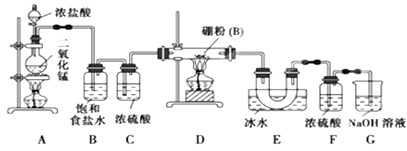
题目内容
【题目】请按要求回答下列问题:
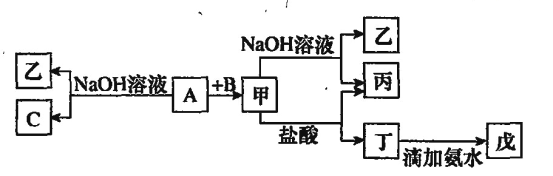
(1)小苏打可用于中和过多的胃酸,该反应的离子方程式为:___。
(2)向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成海绵状的炭。蔗糖变黑,说明浓硫酸具有__性,后产生有刺激性气味的气体,说明浓硫酸具有___性。
(3)NO2是___色的有毒气体,它与水反应的化学方程式为___,该反应中氧化剂与还原剂的质量比为___。
(4)用10mol·L-1H2SO4配制480mL1mol·L-1H2SO4,有如下几个操作:
①计算并用量筒量取___mL10mol·L-1H2SO4稀释。
②配制溶液所用到的玻璃仪器除烧杯、玻璃棒外,还必须有__、__![]() 填仪器名称
填仪器名称![]() 。
。
③下列操作可能使所配溶液浓度偏小的是__![]() 填写序号
填写序号![]() 。
。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线
C.配溶液前容量瓶中有少量蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
【答案】H++HCO3-=CO2↑+H2O 脱水 强氧化 红棕 3NO2+H2O=2HNO3+NO 1:2 50.0 500mL容量瓶 胶头滴管 AD
【解析】
(1)盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水;
(2)依据蔗糖遇到浓硫酸脱水碳化,生成的碳被浓硫酸氧化生成二氧化碳,浓硫酸被还原为二氧化硫解答;
(3)二氧化氮为红棕色固体,与水反应生成硝酸和一氧化氮,分析反应中元素化合价变化,判断氧化剂还原剂及物质的量之比;
(4) ①容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择容量瓶规格,依据浓硫酸体积选择量筒规格;②配制溶液所用到的玻璃仪器除烧杯、玻璃棒、容量瓶、胶头滴管,据此分析;③根据![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
(1)盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水,离子方程式:H++HCO3-=CO2↑+H2O;
故答案为:H++HCO3-=CO2↑+H2O;
(2)向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成海绵状的炭。蔗糖变黑,说明浓硫酸具有脱水性,后产生有刺激性气味的气体,说明浓硫酸具有强氧化性;
故答案为:脱水;强氧化;
(3)二氧化氮为红棕色固体,与水反应生成硝酸和一氧化氮,方程式:3NO2+H2O=2HNO3+NO,反应中3mol二氧化氮参加反应,2mol二氧化氮中氮元素化合价升高,1mol二氧化氮中氮元素化合价降低,所以依据方程式,3mol二氧化氮参加反应,1mol做氧化剂,2mol做还原剂,二者物质的量之比为1:2,则二者的质量之比为1:2;
故答案为:红棕; 3NO2+H2O=2HNO3+NO;1:2;
(4)①由于无480mL的容量瓶,故应选用500mL的容量瓶,配制出500mL1mol/L的溶液, 根据溶液稀释定律C浓·V浓=C稀·V稀可知:1mol/L×500mL=10mol/L×XmL,解得X=50.0mL;
故答案为:50.0;500mL容量瓶;
②配制溶液所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、容量瓶,由于无480mL的容量瓶,故应选用500mL的容量瓶,
故答案为:500mL容量瓶,胶头滴管;
③根据![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
A.未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,则所配溶液的浓度偏低,A项正确;
B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,则所配溶液的浓度偏高,B项错误;
C.定容时还需加入蒸馏水,因此配溶液前容量瓶中有少量蒸馏水并不影响配制溶液浓度,C项错误;
D.摇匀后,容量瓶壁沾有少量水,因此发现液面低于刻度线属于正常现象,继续加水至凹液面与刻度线相切,则导致导致溶液体积偏大,则所配溶液的浓度偏低,D项正确;
故答案为:AD。

 培优好卷单元加期末卷系列答案
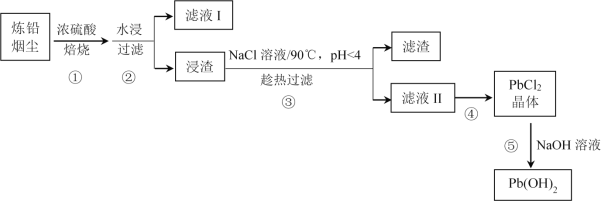
培优好卷单元加期末卷系列答案【题目】炼铅烟尘的主要成分为铅的氧化物(Pb2O3、Pb3O4、PbO)及PbSO4,其杂质主要为含镉(Cd)化合物,回收处理炼铅烟尘可实现资源再生。某工艺流程如图:
已知:ⅰ.Pb2O3![]() Pb3O4
Pb3O4![]() PbO
PbO
ⅱ.CdSO4易溶于水,热稳定性好
ⅲ.PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)
PbCl2(s)+SO42-(aq)
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
ⅳ.Pb(OH)2为两性氢氧化物
(1)步骤①中焙烧的目的是________。在此过程中PbO与浓硫酸发生反应的化学方程式为________。
(2)滤液I的成分是________。
(3)相同反应时间,步骤①中焙烧温度和酸料比对Pb、Cd去除率的影响如下表所示(均未达到平衡状态)。
焙烧温度/℃ | 各元素的去除率/% | 酸料比/(mL/g) | 各元素的去除率/% | ||
Pb | Cd | Pb | Cd | ||
100 | 2.57 | 56.63 | 0.3 | 2.57 | 74.12 |
200 | 2.62 | 89.30 | 0.4 | 2.67 | 85.10 |
500 | 2.67 | 96.98 | 0.5 | 2.72 | 92.48 |
600 | 2.87 | 95.42 | 0.6 | 2.67 | 96.98 |
900 | 2.88 | 40.15 | 0.7 | 2.65 | 95.13 |
应选择的焙烧温度和酸料比为________。
Cd去除率随温度升高先增大后减小的原因可能为________。
(4)步骤③中NaCl溶液的作用是________。
(5)步骤④的操作是________。
(6)下列说法正确的是________(填序号)。
A.步骤①中浓硫酸作氧化剂
B.步骤③中pH<4的目的是防止Pb2+水解
C.步骤④的滤液可循环利用以提高Pb的回收率
D.步骤⑤中增大NaOH溶液浓度可使Pb沉淀完全