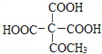题目内容
【题目】将各有机物的序号按相关量由大到小的顺序排列:
(1)密度:①CCl4 ②CHCl3 ③H2O___________
(2)熔点:①2,3一二甲基丁烷 ②2一甲基丁烷 ③戊烷___________
(3)同质量的物质完全燃烧耗O2量:①甲烷 ②乙烯 ③乙炔___________
(4)同物质的量物质完全燃烧耗O2量:①环己烯 ②甲苯 ③苯甲酸___________
同质量的烃完全燃烧耗O2量多少的判断依据是________________________;
同物质的量的有机物(CxHyOz)完全燃烧耗O2量的判断依据是______________。
【答案】 ①②③ ①③② ①②③ ②①③ 含氢质量分数大的烃耗氧多 x+y/4-z/2大的有机物耗氧多
【解析】(1)含-Cl原子数越多,密度越大,一氟代烃、一氯代烃的密度比水小,其它氯代烃的密度比水大,故密度CCl4> CHCl3> H2O;(2)烷烃碳原子越多,熔点越高,烷烃的同分异构体中支链越多,熔点越低,故熔点:2,3一二甲基丁烷>戊烷>2一甲基丁烷;(3)若烃为CxHy,同质量的物质燃烧耗O2量为![]() ×(x+
×(x+![]() ),显然甲烷消耗氧气最多,大小顺序为甲烷>乙烯乙炔;(4)若有机物为CxHyOz,同物质的量物质燃烧耗O2量为x+
),显然甲烷消耗氧气最多,大小顺序为甲烷>乙烯乙炔;(4)若有机物为CxHyOz,同物质的量物质燃烧耗O2量为x+![]() -
-![]() ,消耗氧气为甲苯>环己烯>苯甲酸;烃为CxHy,同质量的物质燃烧耗O2量为
,消耗氧气为甲苯>环己烯>苯甲酸;烃为CxHy,同质量的物质燃烧耗O2量为![]() ×(x+
×(x+![]() ),可知含氢质量分数大的烃耗氧多;同物质的量的有机物(CxHyOz)完全燃烧耗O2量x+
),可知含氢质量分数大的烃耗氧多;同物质的量的有机物(CxHyOz)完全燃烧耗O2量x+![]() -
-![]() ,值越大的有机物耗氧多。
,值越大的有机物耗氧多。

 智慧小复习系列答案
智慧小复习系列答案【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g)![]() 2D(g)△H=Q kJ·mol–1。相关条件和数据见下表:
2D(g)△H=Q kJ·mol–1。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/ mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K 2 | K 3 |
下列说法正确的是
A. K 3>K 2=K 1
B. 实验Ⅱ可能使用了催化剂
C. 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的![]() 倍
倍
D. 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动
【题目】回答下列问题:
(1)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B===H++HB-;HB-![]() H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(2)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为________________,少量CO2与NaHS反应的离子方程式为______________。