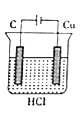
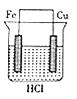
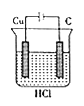
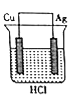
题目内容
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图。下列说法不正确的是

A. 酸溶时,常需将烧渣粉碎、并加入过量H2SO4,其目的是提高铁元素的浸出率,同时抑制铁离子的水解
B. 反应②的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2S042-+16H+
C. 加入NH4HCO3生成FeCO3,检验FeCO3是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴如盐酸酸化的氯化钡溶液,若无沉淀生成说明洗涤干净
D. 锻烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
【答案】D
【解析】
本题考查的是物质的制备和分离操作,侧重于学生的分析能力、实验能力和综合运用化学知识能力的考查,为高考常见题型,注意根据实验流程以及相关物质的性质解答该题。
A.烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)酸浸时Fe2O3、Fe3O4、FeO能与稀硫酸反应得到亚铁离子和铁离子,酸浸时,常需要将烧渣粉碎,通过增大接触面积,提高铁元素的浸出率,因亚铁离子和铁离子都容易水解成酸性,通过加入过量硫酸,抑制水解,故正确;B.滤液中加入FeS2+将铁离子还原为亚铁离子,-1价的硫被氧化生成+6价的硫,FeS2 - S042-,失去14e-,Fe3+ -Fe2+,得到e-,最小公倍数为14,根据得失电子守恒、原子守恒和电荷守恒,离子反应方程式为FeS2+14Fe3++8H2O=15Fe2++2S042-+16H+,故正确;C.碳酸氢铵能和酸反应生成硫酸铵和二氧化碳,同时能调节溶液的pH,使亚铁离子全部转化为碳酸亚铁,过滤得到碳酸亚铁,滤液中有硫酸铁,所以操作为取最后一次洗涤滤液,滴加 酸化排除碳酸根离子的干扰,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净,故正确;D.煅烧时空气中的氧气做氧化剂,用氯气代替空气会生成氯化铁,不能得到高纯氧化铁,故错误。故选D。

【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | V A | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,在这些元素中,化学性质最不活泼的是:________________(填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是_________,碱性最强的化合物是/span>_________。
(3) 最高价氧化物是两性氧化物的元素是_________。
(4) 元素④与⑥形成的化合物属于___________________ (填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式 __________________。
(6)写出⑥的原子结构示意图_____________ 。
【题目】为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的铵根离子全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
实验序号 | I | II | III | IV |
NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=_____g;c(NaOH)=_____molL﹣1。
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为_____。