题目内容
19.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法不正确的是( )| A. | 开始滴加氨水时形成的难溶物为Cu(OH)2 | |
| B. | 沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+配位数为4 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| D. | [Cu(NH3)4]2+中,Cu2+提供空轨道,NH3给出孤电子对 |
分析 氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液;
A.硫酸铜先和氨水反应生成氢氧化铜蓝色沉淀;
B.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物;
C.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
D.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键.
解答 解:氨水呈碱性,向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物氢氧化铜,Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,原因是氢氧化铜和氨水反应生成了铜氨络合物,反应为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-;
A.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,反应为:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+,故A正确;
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+中,Cu2+为中心离子,电荷数为+2,NH3为配体,配位数为4,故B正确;
C.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,铜离子转化到络合物离子中,所以溶液中铜离子浓度减小,故C错误;
D.在[Cu(NH3)4]2+离子中,铜离子含有空轨道,氨气分子含有孤电子对,所以Cu2+提供空轨道,NH3给出孤电子对,故D正确;
故选C.
点评 本题考查了配合物、配位键的形成等性质,题目难度中等,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.注意配位键属于共价键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 ? NaOH H2O | D. | NH3 H2O CO2 |
10.下列有关物质的性质与应用不相对应的是( )
| A. | 氨气能与氯气生成氯化铵,可用浓氨水检验输送氯气的管道是否泄漏 | |
| B. | SO2有强还原性,用SO2漂白纸浆 | |
| C. | 熟石膏与水的糊状混合物会很快凝固,可用它制作模型和石膏绷带 | |
| D. | 铝有强还原性且转化为氧化铝时放出大量的热,可用铝粉来还原某些金属氧化物 |
7.下列有关化学实验安全的叙述中正确的是( )
| A. | 点燃的酒精灯不小必打碎了,可先用自来水灭火 | |
| B. | 皮肤沾上浓碱后可先用水洗后再用稀硼酸涂抹 | |
| C. | 制备蒸馏水中,为防止暴沸可将混合液加热一段时间后再加放碎瓷片 | |
| D. | 冷凝管用作冷凝回流时,为防止有机物蒸汽逸出,可使用橡胶塞封末端出口 |
4.最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 辛烯和3甲基1丁烯 | B. | 苯和乙炔 | ||
| C. | 1氯丙烷和2氯丙烷 | D. | 甲苯和乙苯 |
11.足量MnO2与VmL 10mol/L的盐酸共热制氯气,在标准状况下制2.24LCl2则V的取值为( )
| A. | V>40 | B. | 20<V<40 | C. | V=40 | D. | V=20 |
8.下列各组物质中,分类完全正确的一组是( )
| A酸 | B碱 | C盐 | D氧化物 |
| H2SO4 | Ba(OH)2 | H2S | H2O2 |
| NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
| HNO3 | NaOH | CaCO3 | CuO |
| HCl | Na2CO3 | CuSO4 | MnO2 |
| A. | A | B. | B | C. | C | D. | D |
9.既能和氢气发生加成反应,又能和卤素发生取代反应,又能被酸性高锰酸钾溶液氧化的烃是( )
| A. | 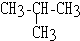 | B. | CH2=CH2 | C. | 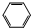 | D. | 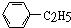 |