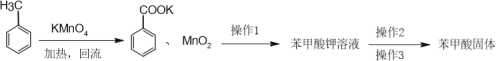
题目内容
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
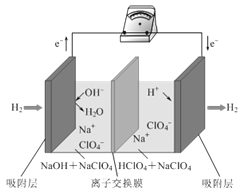
A.“全氢电池”工作时,将化学能转化为电能
B.电池的总反应是2H2+O2=2H2O
C.负极的电极反应是H2-2e-+2OH-=2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
【答案】B
【解析】
全氢电池作为供电用的电源时,其能量转化形式必然是化学能变为电能。通过分析工作原理示意图可知,全氢电池工作时,负极消耗氢气,正极生成氢气,由电子得失守恒可知,两极消耗和生成的氢气量必然相等;因此,全氢电池总反应并非消耗氢气的反应。考虑到负极消耗氢气的同时,又消耗了溶液中的OH-,正极则通过将H+还原的方式获取氢气;因此,总反应实质是消耗H+和OH-的中和反应。
A.电池中能量的转化形式为化学能转变成电能,A项正确;
B.通过分析可知,全氢电池的总反应为:![]() ,B项错误;
,B项错误;
C.由图分析可知,负极发生的是H2得电子,最终转变为H2O的反应,C项正确;
D.由图分析可知,全氢电池,左边的电极为负极,右边的电极为正极,所以Na+向右移动,![]() 向左移动,D项正确;
向左移动,D项正确;
答案选B。

练习册系列答案
相关题目