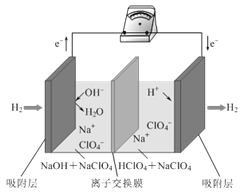
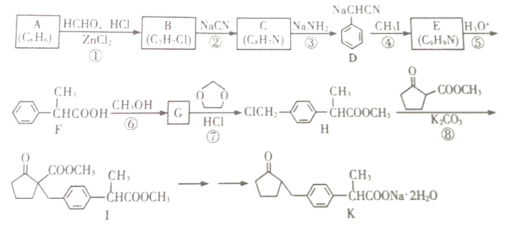
题目内容
【题目】已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
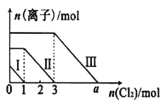
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
【答案】A
【解析】
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性强弱:I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再发生反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应:2Br-+Cl2=Br2+2Cl-,故线段Ⅰ代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;通入氯气,根据反应离子方程式,n(I-)=2n(Cl2)=2mol,n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒,n(I-)+ n(Br-)=2n((Fe2+),故n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,据此分析作答。
A.溶液中n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,A正确;
B.线段Ⅰ代表I-的变化情况,B错误;
C.线段Ⅲ代表Br-的变化情况,C错误;
D.n((Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,而n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,则原混合溶液中n(FeBr2)=![]() n(Br-)=3mol,D错误;
n(Br-)=3mol,D错误;
故答案为:A。

【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)