题目内容
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应: A(s)+2B(g) C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是
| A.混合气体的压强 | B.混合气体的密度 |
| C.气体的总物质的量 | D.单位时间内生成n mol C的同时消耗2n molB |
B
解析试题分析:A. 由于该反应是反应前后气体体积相等的反应,所以无论反应是否达到平衡,混合气体的压强都不变,故不能作为平衡的标志,错误;B.由于反应体系中气体的质量是可变的反应,若反应未达到平衡,则气体的质量就会发生变化,混合气体的密度就会发生变化,若混合气体的密度不再改变,则反应达到平衡,正确;C. 由于该反应是反应前后气体体积相等的反应,所以无论反应是否达到平衡,混合气体的总物质的量不变,所以不能作为平衡的标志,错误;D由于方程式中B、C的物质的量的比是2:1,所以在任何时刻单位时间内生成n mol C的同时消耗2n molB,故不能确定反应达到平衡,错误。
考点:考查可逆反应平衡状态的判断的知识。

向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g) 2Z(g)
2Z(g)
ΔH<0,4min后达到平衡c(X)=0.2mol·L-1,且X与Y的转化率相等。下列说法中不正确的是( )
| A.达到平衡时,再充入1molX,反应的焓变保持不变 |
| B.用Y表示4min内的反应速率为0.1 mol·L-1·min-1 |
| C.再向容器中充入1molZ,达到新平衡,c(X)∶c(Y)=2∶1 |
| D.4min后,若升高温度,平衡常数K增大 |
下列四个数据都表示合成氨的反应速率,其中代表同一反应速率的是
①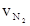 = 0.3mol·L-1·min-1 ②
= 0.3mol·L-1·min-1 ②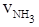 = 0.9 mol·L-1·min-1
= 0.9 mol·L-1·min-1
③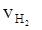 = 0.015 mol·L-1·s-1 ④
= 0.015 mol·L-1·s-1 ④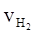 = 2.25 mol·L-1·min-1
= 2.25 mol·L-1·min-1
| A.①② | B.①③ | C.③④ | D.②④ |
下列实验中,反应速率加快属于由催化剂引起的是
| A.氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 |
| B.过氧化氢中加入几滴氯化铁溶液,可较快放出气体 |
| C.在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 |
| D.用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
把下列四种X的溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时X和盐酸缓和地进行反应,其中反应速率最大的是( )
| A.10 mL 2 mol·L-1 | B.20 mL 2 mol·L-1 | C.10 mL 4 mol·L-1 | D.20 mL 3 mol·L-1 |
下列各组反应(表内物质均为反应物)刚开始时,放出H2速率最大的是
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.1 mol | 18.4 mol/L H2SO4 | 10 mL | 60 ℃ |
| B | Mg | 0.1 mol | 3 mol/L HCl | 10 mL | 30 ℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
下列条件的改变,一定能加快化学反应速率的是
| A.增大压强 | B.升高温度 |
| C.增大反应物的量 | D.减小生成物的浓度 |
下列叙述中一定能判断某化学平衡发生移动的是( )
| A.混合物中各组分的浓度改变 | B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 | D.混合体系的压强发生改变 |
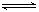 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是