��Ŀ����
����Ŀ����������﮵��װ����ͼ��ʾ�����������������ʯ��LiFePO4ͨ��ճ�ϼ��������������棬����ʯī���ϸ�����ͭ�����棬�����Ϊ�ܽ����л��ܼ��е���Σ� 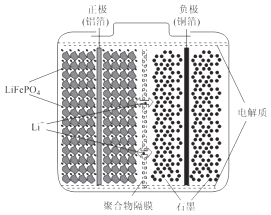
��1����ع���ʱ���ܷ�ӦΪ��LiFePO4+6C ![]() Li1��xFePO4+LixC6 �� ��ŵ�ʱ�������ĵ缫��ӦʽΪ �� ���ʱ��Li+Ǩ�Ʒ���Ϊ����������ҡ�������������ͼ�оۺ����ĤӦΪ������������������ӽ���Ĥ��
Li1��xFePO4+LixC6 �� ��ŵ�ʱ�������ĵ缫��ӦʽΪ �� ���ʱ��Li+Ǩ�Ʒ���Ϊ����������ҡ�������������ͼ�оۺ����ĤӦΪ������������������ӽ���Ĥ��
��2���øõ�ص�⾫��ͭ�����÷ŵ�ĵ���ǿ��I=2.0A�ĵ�ع���10���ӣ���⾫��ͭ�õ�ͭ0.32g�����������Ч��Ϊ������С�����һλ���� ����֪�������ڳ���F=96500C/mol����������Ч��= ![]() ��100%��
��100%��
���𰸡�
��1��Li1��xFePO4+xLi++xe���TLiFePO4���������ң���
��2��80.4%
���������⣺��1����ع���ʱ���ܷ�ӦΪ��LiFePO4+6C ![]() Li1��xFePO4+LixC6���ŵ�ʱ��Li1��xFePO4�������ϵõ��ӷ���������Ӧ��������ӦΪLi1��xFePO4+xLi++xe���TLiFePO4�����ʱ����������ӵ�Դ����������Ϊ�������������������ƶ�����Li+���������ƶ��������Ϊ��Σ������ͨ������Ĥ�������ƶ������Խ���ĤӦ��Ϊ�����ӽ���Ĥ��
Li1��xFePO4+LixC6���ŵ�ʱ��Li1��xFePO4�������ϵõ��ӷ���������Ӧ��������ӦΪLi1��xFePO4+xLi++xe���TLiFePO4�����ʱ����������ӵ�Դ����������Ϊ�������������������ƶ�����Li+���������ƶ��������Ϊ��Σ������ͨ������Ĥ�������ƶ������Խ���ĤӦ��Ϊ�����ӽ���Ĥ��
���Դ��ǣ�Li1��xFePO4+xLi++xe���TLiFePO4���������ң�������2��LiFePO4+6C ![]() Li1��xFePO4+LixC6����⾫��ͭ�õ�ͭ0.32gʱ����ͭ�����ʵ���Ϊ
Li1��xFePO4+LixC6����⾫��ͭ�õ�ͭ0.32gʱ����ͭ�����ʵ���Ϊ ![]() =0.005mol�����Ե�����ĵĵ���Q=2��0.005mol��96500C/mol=965C�����ݷŵ�ĵ���ǿ��I=2.0A����ع���10���ӣ��ɼ���õ�ص��������Q=It=2.0��10��60=1200C�����ݵ�������Ч��=
=0.005mol�����Ե�����ĵĵ���Q=2��0.005mol��96500C/mol=965C�����ݷŵ�ĵ���ǿ��I=2.0A����ع���10���ӣ��ɼ���õ�ص��������Q=It=2.0��10��60=1200C�����ݵ�������Ч��= ![]() =
= ![]() ��100%=80.4%��
��100%=80.4%��
���Դ��ǣ�80.4%��

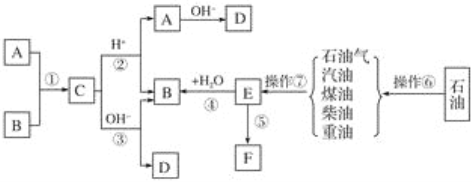
 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�