题目内容
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:
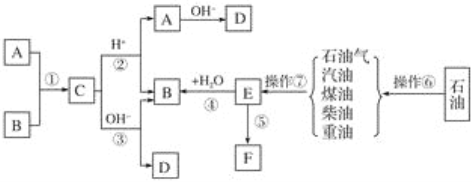
(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A.汽油 B.煤油
C.柴油 D.重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:____________________________________________________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
【答案】 分馏 裂解 D ①②③ ④⑤ CH3COOH ![]() CH3COOCH2CH3+OH-―→CH3COO-+C2H5OH 白色污染
CH3COOCH2CH3+OH-―→CH3COO-+C2H5OH 白色污染
【解析】石油经过分馏可生产石油气、汽油、柴油等产品,而上述产品再经过高温裂解可制得乙烯、丙烯等化工产品,而E是石油化工发展水平的标志,故E为乙烯,则F为聚乙烯,B为乙醇。由框图知C为乙醇与酸A发生酯化反应生成的酯,且A为家庭中常见有机物,故A为乙酸,C为乙酸乙酯,其它答案可依次推出。
(1)石油是混合物,各物质的沸点不同,因此采用分馏的方法进行分离,得到各种烃的混合物;由于石油气、煤油、汽油、柴油、重油中碳原子较多,沸点较高,通过裂化,把长链烃变为短链,因此操作⑥、操作⑦的名称分别为分馏;裂解;正确答案:分馏;裂解。
(2)含碳数越多,沸点越高,因此重油的沸点最高;正确答案:D。
(3)反应①为乙酸和乙醇发生取代反应生成酯;反应②为乙酸乙酯在酸性条件下发生水解反应;反应③为乙酸乙酯在碱性条件下发生水解反应;反应④为乙烯与水发生加成反应生成乙醇;反应⑤为乙烯发生加聚反应生成聚乙烯;因此在①~⑤中属于取代反应的是①②③;原子利用率为100%的反应是为④⑤;正确答案:①②③;④⑤;
(4)结合以上分析可知:A为乙酸,结构简式为:CH3COOH;F为聚乙烯,结构简式为![]() ;正确答案:CH3COOH,
;正确答案:CH3COOH,![]() 。
。
(5)写出反应③的离子方程式:乙酸乙酯在碱性环境下发生水解:CH3COOCH2CH3+OH-―→CH3COO-+C2H5OH;正确答案:CH3COOCH2CH3+OH-―→CH3COO-+C2H5OH。
(6)乙烯加聚生成聚乙烯,不可降解,造成了白色污染;正确答案:白色污染。

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H 下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为热反应(填“吸”或“放”).
某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为(从表中选择).
(2)已知在常温常压下: ①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法: 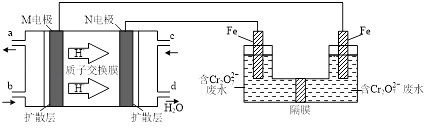
①N电极的电极反应式为 .
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72+Fe2++═Cr3++Fe3++
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5molL﹣1 时,Cr3+沉淀完全,此时溶液的pH= . (已知,Ksp=6.4×10-31 , lg2=0.3)