题目内容
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物与其氢化物能发生化合反应生成一种盐,D元素是地壳中含量最高的元素。回答下列问题:
(1)C元素的名称是____,在周期表中的位置是________。
(2)化合物BD2的结构式是_________,化合物EA的电子式是___________。
(3)A、D、E三种元素形成的化合物中含有的化学键类型有_________。
(4) D、E元素分别形成的简单离子半径大小关系是_____(用离子符号表示);B、C元素分别形成的简单气态氢化物的稳定性大小关系是___________(用化学式表示)。
(5)C元素的简单气态氢化物遇到蘸有浓硝酸的玻璃棒的现象是_________,其原因是_________(用化学方程式解释)
【答案】氮 第二周期ⅤA族 O=C=O ![]() 离子键、共价键 O2->Na+ CH4<NH3 有白烟产生 NH3+HNO3=NH4NO3
离子键、共价键 O2->Na+ CH4<NH3 有白烟产生 NH3+HNO3=NH4NO3
【解析】
A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的原子半径是所有原子中最小的,所以A为H;A、E同主族,则E为Na;B元素原子的最外层电子数是内层电子数的2倍,则B为C;C元素的最高价氧化物的水化物与其氢化物能发生化合反应生成一种盐,则C为N;D元素是地壳中含量最高的元素,则D为O。所以A、B、C、D、E分别为H、C、N、O、Na。
由以上分析可知:
(1)C元素为N,名称是氮,在周期表中位于第二周期第ⅤA族。
(2)化合物BD2为CO2,每个氧原子都和碳原子共用2对电子,电子式为![]() ,结构式是O=C=O;化合物EA为NaH,是离子化合物,电子式是
,结构式是O=C=O;化合物EA为NaH,是离子化合物,电子式是![]() 。
。
(3)A、D、E三种元素形成的化合物为NaOH,是Na+和OH-间通过离子键结合而成的离子化合物,OH-是由H和O通过共有电子对形成的,所以NaOH含有的化学键类型有离子键、共价键。
(4) D、E元素分别形成的简单离子O2-和Na+电子层结构相同,当两种微粒电子层数相同时,质子数越多,半径越小,所以半径O2->Na+;B、C元素分别形成的简单气态氢化物CH4和NH3的稳定性和元素的非金属性有关,非金属性越强,气态氢化物的稳定性越强,所以稳定性:CH4<NH3。
(5)C元素的简单气态氢化物NH3遇到蘸有浓硝酸的玻璃棒,两者会化合生成白色固体NH4NO3:NH3+HNO3=NH4NO3,看到产生白烟。

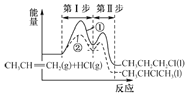
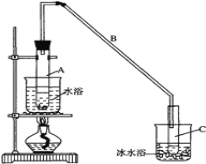
【题目】某化学小组采用如图装置,以环己醇制备环己烯:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知:
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,
在试管C内得到环己烯粗品。
①试管C置于冰水浴中的目的是 _____________________________________。
②导管B除了导气外还具有的作用是____________,A中碎瓷片的作用是 ___________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______ 层(填“上”或“下”),分液后用___________________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是:_________________________。
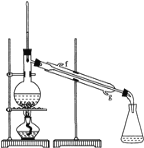
③收集产品时,控制的温度应在________________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 _______
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点