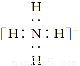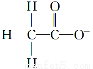题目内容
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
请回答下列问题:
(1)该反应的热化学方程式为_______________________________________________。
(2)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与双氧水反应生成液态水时放出的热量是________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________________________________________________________________。
(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
(2)408.815
(3)对环境无污染
【解析】解答本题的关键是先判断N2H4、H2O2中N、O的化合价:N2H4中N为-2价、H2O2中O为-1价。根据氧化还原反应方程式的配平原则,配平后的方程式为N2H4+2H2O2=N2↑+4H2O↑。所以该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1。
若生成的水为液态,其热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH=-817.63 kJ·mol-1。

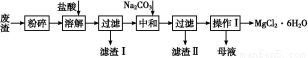
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25 ℃时有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式 。
(2)溶解时温度不能太高,也不宜太低,要求控制在35 ℃左右,其理由是 。
(3)操作Ⅰ包含多个操作,分别为 ,过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。