题目内容
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.12g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
【答案】D
【解析】
A.12g NaHSO4晶体的物质的量是![]() =0.1mol,NaHSO4晶体中存在钠离子和硫酸氢根离子,阳离子和阴离子的总数为0.2NA,故A错误;
=0.1mol,NaHSO4晶体中存在钠离子和硫酸氢根离子,阳离子和阴离子的总数为0.2NA,故A错误;
B.2mol一氧化氮与1mol氧气恰好反应生成2mol二氧化氮,由于存在反应N2O42NO2,所以反应后的混合气体的物质的量小于2mol,所含分子数小于2 NA,故B错误;
C.6.4g铜为0.1mol,硫反应会生成硫化亚铜,铜元素被氧化为+1价,故0.1mol铜参与反应时转移电子数目为0.1NA,故C错误;
D.在乙醇水溶液中,乙醇和水均含H-O键,而含有的乙醇的物质的量n=![]() =0.1mol,故乙醇中含有的H-O键为0.1NA个;含有的水的物质的量n=
=0.1mol,故乙醇中含有的H-O键为0.1NA个;含有的水的物质的量n=![]() =0.3mol,而水分子中含2条H-O键,故0.3mol水中含0.6NA条H-O键,故此水溶液中共含0.7NA条H-O键,故D正确;
=0.3mol,而水分子中含2条H-O键,故0.3mol水中含0.6NA条H-O键,故此水溶液中共含0.7NA条H-O键,故D正确;
故选D。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO47H2O晶体,其流程图如下:
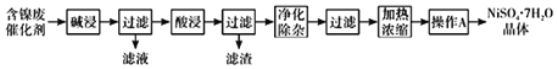
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为______。
(2)“酸浸”所使用的酸为______。
(3)“净化除杂”需加入H2O2溶液,其作用是______。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______。
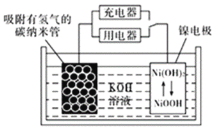
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______。
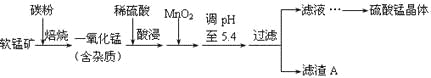
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,并探究溴乙烷的性质。反应原理和实验装置如下(加热装置未画出):
H2SO4(浓)+NaBr![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O

有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
Ⅰ.溴乙烷的制备:
(1)若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,其化学方程式为__________;F连接导管通入稀NaOH溶液中,其目的主要是_________;导管E的末端须低于D的水面,其目的是__________。
(2)为了除去粗产品中的氧化性杂质,宜选择下列_________ (填序号)溶液来洗涤所得粗产品。
A.氢氧化钠 B.碘化钾 C.碳酸氢钠 D.亚硫酸钠
(3)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。从乙醇的角度考虑,本实验所得溴乙烷的产率是___________。
Ⅱ.溴乙烷性质的探究
用如图乙实验装置(铁架台、酒精灯略)验证溴乙烷的性质:在试管中加入10mL6mol·L1NaOH溶液和2mL溴乙烷,振荡、静置,液体分层,水浴加热。
(4)观察到___________,表明溴乙烷与NaOH溶液已完全反应。
(5)为证明溴乙烷在NaOH乙醇溶液中反应的气体产物为乙烯,将生成的气体通入如图丙装置。a试管中的水的作用是 ___________,若无a试管,b试管中的试剂应为___________ 。
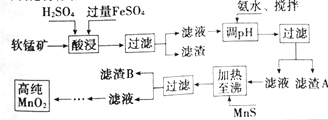
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%),Fe(5.86%),Al(3.42%),Zn(2.68%)和Cu(0.86%)等元素的氧化物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP近似值 | 10-34 | 10-16 | 10-38 |
(1)灼烧软锰矿样品时,铜的焰色为___(填字母)。
A.黄色 B.绿色 C.紫色 D.红色
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子反应方程式为___。
(3)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___。滤渣S的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)滤渣B的成分是___。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中10.00mL,恰好与25.00mL0.0800 mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算该样品纯度为___%(精确到0.1%)。
(6)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种)。